美国定制类医疗器械监管模式如何?
(原创2017-12-05 CMDE中国器审)
一、概述
近年来,“定制式”、“个性化”、“3D打印”等词语被广泛地应用于医疗领㊣ 域,一方面说明了公众对于疾病诊断水平的要求在不断提升,另一方面也体现出医疗服务正在向“精准化”发展。美国从上世纪三十年代末开始对医疗器械进行立法,是世界上较早开展医疗器械监管的国家之一,其医疗器械监管的要↓求和经验一直是各国医疗器械监管部门的重要参考依据,本文将梳理美国常规医疗器▓械、定制器械、患者匹配器械、人道主义用器械、3D打印器械的监管模式,以供相关方参考。
二、美国常规医疗器械监管模式1
美国食品药品监督管理局(FDA)依据医疗器械的风险等级对产品实行分类管理,包括第I、Ⅱ、Ⅲ类医疗器械。不同风险产品应对应不同的上市要求。其中,对于具有中等到较高风险的第Ⅱ类医疗器械,FDA通过一般控制和特殊控制(即需符合性能标准)来降低产品的风险,申请人需要将申报产品与已上市产品进行实质性等同比较,以获得上市前通告(以下简称“510(k)”)。对于具有较高临床风险,或是用于维持生命的第Ⅲ类器械,如心脏起搏器、乳房植入假体等产品,FDA实行严格的上市前审批(以下简称PMA)制度,申请人需要提交包括理化性能、机械性能、生物相容性、动物实↓验等内容的临床前研究资料,以及人体临床试验研究数据来证明产品的安全和有效。
1注:本文中“常规医疗器械”指通过510(k)和PMA审批上市的产品,不包括人道主义用器械、定制器械等豁卐免510(k)和PMA要求、可另行审评审批的器械产品。
三、美国定制类医疗器械监管模式
定制类器械(Customized Device)泛指具有“个性化设计”和“定制式生产”特点的医疗器械。在美国,定制类器械可包括定∑ 制器械(Custom Device)和患者匹配器械(Patient-matched Device or Patient-specific Device)两种亚型2,FDA分别采用不同的模式进行监管。其中,患者匹配器械遵循常规医疗器械的监管模式,而定制器械则根据特定要求,采用简化的监管模式。
2注:为方便理解而归类,非官方定义。
1、定制器械
FDA于1976年颁布的《联邦食品、药品和化妆品法案》(以下简称“食药化法”)修订案,首次提出了△定制器械。2012年《食品和药品监管安全和创新法案》中补充增加了对于定制器械临床使用和上市后管理的限定,完善了监管要求。2014年9月,FDA正式发布《定制器械豁免》(Custom Device Exemption)指南文件[1]详细解读了定制器械的法规条款和相关要求。
FDA在定制器械豁免指南中特别指出,只有同时满足食药化法第520(b)条款各项要求时,医疗器械才可以被认定为定制器械。食药化法第520(b)款具体明确了以下使用条件和要求:
(1)应ζ 一名临床医生提出书面要求而生产加工;
(2)上市前审批可豁免第514条款和第515条款相关要求3;
(3)不是市场流通器械;
(4)产品设计应满足独特的病理解剖和生理条件,且境内尚无用于治疗该疾病(情况)的器械;
(5)产品用以满足临床医生特殊的操作需要,或为由临床医生提出预期用于一名患者4;
(6)可由部件组装而成,也可以是特别加工处理○制成的;
(7)可能具有与已上市器械相同的标准化的设计特征、化学等材料组成以及生产加工方式?
(8)仅用于治疗非常罕见的疾病情况,例如预期使用人数少,不足以开展临床试验的情形;
(9)年生产数量不【得超过5件;
(10)生产企业应按规定进行生产,并每年向FDA提交上一年度报告?
食药化法案第520(b)款中明确了定制器械可以豁免510(k)和PMA审批时的具体要求,这是由其设计生产和临床应用特点决定的。但作为医疗器械产品,定制器械仍要满足质量管理体系基本要求,包括企业※登记和器械列名、设计控制、医疗器械不良事件上报等。同时,应在标签中明示定制器械的相关信息。
与常规医疗器械相比,定制器械上市前审批要求较低,但FDA也明确了详细的上市后监管要求,其中最重要的是生产企业应提交每个定制器械的年度报告▆。根据定制器械的预期使用人员(即患者或医生),生产企业应撰写相应的年度报告。
3注:第514条款和第515条款分别指医疗器械一般应符合的性能标准要求和PMA要求。
4注:前者可被称为医生中心(physician-centric)定制器械,后者被称为患者中心(patient-centric)定制器械。
2、患者匹配器械
除定制器械外①,还有一种定制类医疗器械,即患者匹配器械。《定制器械豁免》指南文件中对患者匹配器械进行了描述,即批准一个规格范围的产品,其适用人群是可进行临床研究的患者群体。患者匹配器械采用与常规医疗器械相同的监管模式,可以通过510(k)或PMA批准上市。对于患者匹配器械,FDA仅批准产品的规格尺寸范围,而不是常规医疗器械所具有的设计定型的规格尺寸。医生应根据患者匹配器械的批准范围开具处方,并交由生产企业完成生产加工过程。
根据FDA公布信息,目前已批准的患者匹配器械主要包括骨科手术导板、骨科关节置换假体、颞下颌关节假体、齿科基桩等,这些产品均获得510(k)批准上市,通过︾与参照器械(Predicate Device)进行比较,证明申报产品与已上市产品实质性等同。其中,参照器械可以是已上市的其他患者匹配器械,也可以是规格尺寸定型的常规器械;既可以是通过传统工艺生产的医疗器械,也可以是用新工艺(如3D打印)加工而成的产品。参比项目主要是产品的预期用途、适应证、设计和材料等,并不体现加工工艺。
四、美国人道主义用器械的监管模式
FDA于1990年《医疗器械安全法案》中提出人道主义用器械(Humanitarian Use Device)的认定条件和审批模式,鼓励企业研发用于治疗或诊断罕见病的人道主ξ 义用器械。其中人道主义用器械应同时满◤足如下条件[2]:
(1)用于治疗或诊断患病率极低的疾病,该疾病每年在美国的影响人数少于4,000人;
(2)尚无其它已上市器械能够治疗该疾病;
(3)使用该器械不会给患者带来严重的、不合理的风险;
(4)可能给患者带来的益处超过疾病或损伤的风险?
虽然人道主义用器械与定制类器械相比,都仅适用于小部分患者(群体)。但是,定制类器械关注个体间解剖□结构和生理状况的差异,每个产品的最终规格尺寸不同;而某个适应证下特定患者人群适用的人道主义用器械的规格尺寸可能是相同的。
2016年12月,美国议会通过《21世纪治愈法案》(21st Century Cures Act),修订了人道主义器械的定义,将原有罕见病人数限制从“少于4,000人”改为“不多于8,000人”。同时,根据修订后的罕见病影响人数,进一步放宽了人道主义用器械的年度销售数量,即销售量在“人均年使用量×8,000”范围内的部分允许获利。超过部分可以继续销售,但是本年度内剩余时间内不能获取利润[3]。
五、美国3D打印器械的监管模式
3D打印是快速实现、精准制造的生产加工方式,也是目前流行的增材制造工艺的一个类型,自二十世纪八十年代起被逐渐应用到了医疗器械领域。与传统的“减材制造”相比,该技术适合生产具有复杂结构的医疗器械,如人体骨骼组织和器官。所以,3D打印技术无疑是实现定制器械或患者匹配器械的一个重要途径。需要注意的是,FDA并没有为3D打印器械另行制定相应的〖监管模式,仍需通过510(k)或PMA批准上市。究其原因,FDA风险分类的依据是产品预期用途,而非产品生产加工方式。根据FDA目前公布的信『息,已有近百个3D打印医疗器械产品获得批准,包♂括气管夹板、颅骨板、髋关节假体、脊柱椎间融合器和齿科/骨科重建产品,均为第Ⅱ类医疗器械,通过510(k)申请上市,目前尚无PMA申请的3D打印器械。
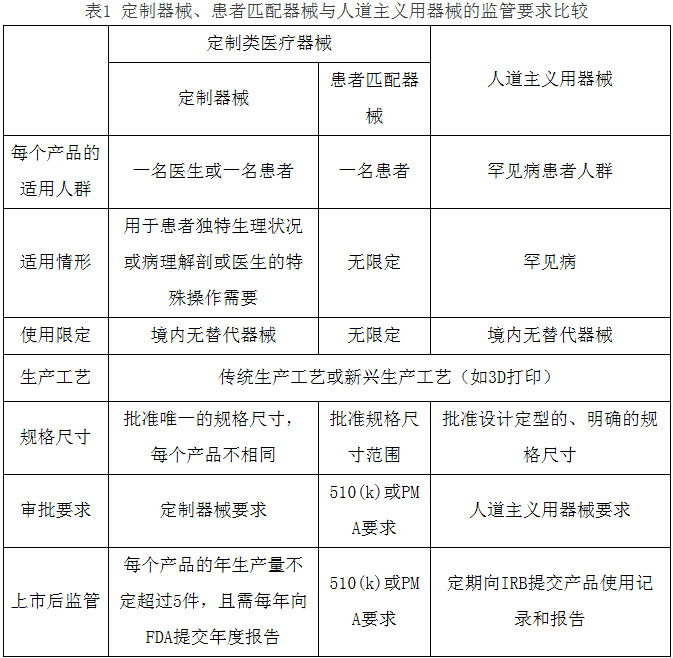
六、比较研究
FDA根据器械临床使用风险对器械进行分类和监管,表1中比较了包括定制器械和患者匹配器械在内的定制类器械,与人道主义用器械在适『用人群、适应证、使用限定、规格尺寸、加工工艺、审批要求、上市后监管等■七个方面的分析和比较。
表1定制器械、患者匹配器械与人道主义用器械的监管要求比较
七、思考
生产企业应对定制类器械进行全生命周期风险管理。定制类医疗器械之所以可以实现个性化医疗,主要经过一系列工序完成。首先,医生需要对患者进行影像扫描和数据采集,这不仅是诊断的一部分,同时也是定制类器械设计输入的开端。其次,工程人员使用计算机建模和作图软件精确重建患者解剖结构,并与临床医生一起确定假体设计和手术方案,完成设计环节。然后,生产人员采用传统工艺或3D打印工艺生产加工出与患者解剖结构具有高匹配度的器械产品。最后,由医生操作将定制类器械应用于临床。相比常规器械,定制类器械研发设计环节很大程度上依赖于患者影像学数据的输入,同时考虑从诊断到治疗过程中病情的变化,医生在定制类器械设计环节将发挥更大的作用。只有临床医生、工程技术人员和生产加工人员共同合作完成医疗器械的设计和手术方案的制定,才能实现定制类产品的预期目标,这就在定制类器械的质量管理体系引入了一个新的风险点。在美国,定制器械的生命周期是从临床医生出具包括详细设计特征的书面处方后开始的。作为风险〗控制的一部分,需要对医生能力进行要求、对其行为进行规范。根据我国实际医疗现状,考虑监管对象,明确将临床机构或临床医生纳入监管的合理性和必要性。一方面,对医疗机构的能力进行确认,可以确保产品设计环节医疗和工程结合@ 的持续性,保证产品的安全、有效和质量可控,使监管的覆盖面更全面。另一方面,义务和权利并存,可以鼓励医生参与医疗器械创新研发,加快研发到临床转化的进程。
如采用3D打印工艺生产定制类器械,生产企业需要针对3D打印所引◆入的包括原材料控制、3D打印机参数设置、产品性能验证等多个环节的风险重新进行评估,制定新的标准化操作程序、验证和确认方案等。
同时,上市后监管对于定制类医疗器械来说也是极其重要的。考虑到定制类器械的临床使用情况,可能出现一个或几个产品作为一个独立批次的情形,产品上市后的追溯、再评价和召回等工作都与常规产品有一定区别。这给企业的上市后监测和监管部门的上市后监管都带来了新的挑战。
除了企业应进行持续的定制类器械全生命周期风险管理外,监管部门同样需要逐步完善定制类医疗器械的法规体系,引导行业健康发展。
参考文献:
[1]U.S.Food and Drug Administration.Custom Device Exemption Guidance for Industry and Food and Drug Administration Staff http://www.fda.gov/downloads/medicaldevices/deviceregulationandguidance/guidancedocuments/ucm415799.pdf
[2]U.S.Food and Drug Administration.Humanitarian Device Exemption(06/04/2015)http://www.fda.gov/medicaldevices/deviceregulationandguidance/howtomarketyourdevice/premarketsubmissions/humanitariandeviceexemption/default.htm
[3]U.S.Food and Drug Administration.Section 3052 of the 21st Century Cures Act(Pub.L.No.114-255).https://www.congress.gov/114/bills/hr34/BILLS-114hr34eah.p
审评四部 闵玥 刘斌 供稿
2017-12-05 15:00