一、全国医疗器械不良事件报告总体情况
2013年,全国医疗器械不良事件报告工作呈现良好的发展态势。报告数量持续增长,已突破23万份,平均百万人口报告数已达179份;不良事件报告的整体质量有所提升;各地对不良事件报告的重视程度明显提高。
(一)2013年可疑Ψ 不良事件报告数量
2013年,国家药品不良反应监◎测中心共收到《可疑医疗器械不良事件报告表》238,650份,与2012年相比增长31.7%。企业后续提交《医疗器械不良事件补充报告表》705份;《医疗器械不良事件年度汇总报告表》1,805份(表1)。
表1 2013年可疑︾不良事件报告数量与2012年比较情况
报告类型 | 报告数量 | 年度增长率(%) | |
2012年 | 2013年 | ||
《可疑医疗器械不良事件报↓告表》 (《医疗器械不良事件补充报告表》) | 181255 (634) | 238650 (705) | 31.7 (11.2) |
《医疗器械不良事件年度汇总报告表》 | 1381 | 1805 | 30.7 |
1.死亡及严重伤害事件报告数量
2013年,国家药品不良反应监测中心共收到死亡不良事件报告75份,严重伤害事件报告34,524份,共计34,599份,占可疑不良事件报告总数的∞百分比为14.5%,比2012年的23,548份增长了46.9%。(图1)。
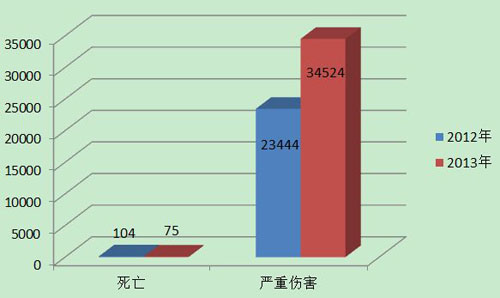
图1 2012-2013年全国死亡及严重伤害事件报告数比较
2.补充报告数量
2013年,国家药品不良反应监测中心共收到医疗器械不良事件补充报告705份,年度增长率11.2%,相对于死亡及严重伤害事件报告的快速增长,承载更多信息的补充报告数量增长缓慢,说明生产企业作为报告主体的主动性不够。各级监测机构对生☉产企业的督促还需加强,在监管同时加大技术指导力度,帮助企业做好监测和报告工作。(图2)。
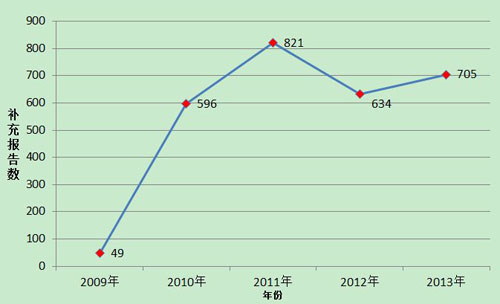
图2 2009-2013年全国医疗器械不良事件补充报告数量
3.年度汇总△报告数量
按照《医疗器械不良事」件监测和再评价管理办法(试行)》的要求,第二、三类医疗器械◇生产企业应当在每年1月底前对上一年度医疗器械不良事件监测情况进行汇总分析,并填写《医疗器械不良事件年度汇总报告表》,报所在↑地省、自治区、直辖市医疗器械不良事件监测技术机构。
2013年,国家药品不良反应监测中心共收到医疗器械不良事件年度汇总报告1,805份,仅占全国现有的二、三类医疗器■械生产企业数量(二类8,255家,三类2,513家)的16.8%。
4.每百万人口平均报告数量
2013年,我国每百万人口平均可疑医疗器械不良事件报告数为179份,已经达到并超过《国◣家药品安全“十二五”规划》中100份/百万人的要求,但各省间发展不平衡,还有1/3的省份百万人口报告数偏低。2013年百万人口平均报告数与2012年相〗比增长了30.7%,与2011年相比增长了94.6%。较之报告总数的增长,百万人口报告数可更好地反映报告数量的增长情况(图3)。
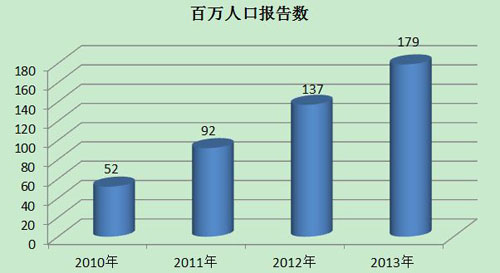
图3 2010-2013年全国百万人口报告数量比较
5.注册基层用户数量
截止到2013年12月31日,在全国医疗器械不良事件监测系统中,注册基层用户(包括生产企业、经营企业和使用单位)共148,585家。其中,医疗器械生产企业8,495家,约占注册基层用户总数的5.7%;经营企业61,498家,约占注册①基层用户的41.4%;使用单位78,592家,约占注册基层用户的52.9%(图4)。
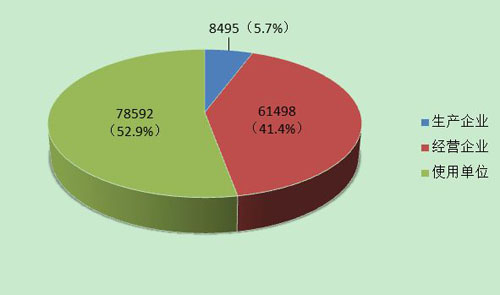
图4 2013年全国医疗器械不良事件监测系统基层用户注册◎情况
2013年,在148,585家注册基层用户中,提交过报告的单位数量为31,505家,占21.2%,基层用户上报情况详见表2。
表2 基层用户上报报告情况
基层用户 | 注册数 | 上报报告的单位数量 | 百分比(%) | |||
总数 | 可疑医疗器械 不良事件报告 | 医疗器械不良 事件补充报告 | 医疗器械不良 事件年度汇总报告 | |||
经营企业 | 61498 | 9576 | 9576 | 0 | 0 | 15.6 |
使用单位 | 78592 | 19335 | 19335 | 0 | 0 | 24.6 |
生产企业 | 8495 | 2594 | 975 | 77 | 1805 | 30.5 |
合计 | 148585 | 31505 | 29886 | 77 | 1805 | 21.2 |
(二)2002年至2013年全国可疑不良事件报告总数量
2002年1月1日至2013年12月31日,国家药品不良反应监测中心累计收到《可疑医疗器械不良事件报告表※》735,559份(图5)。
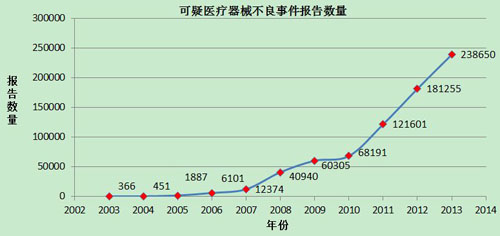
图5 2002-2013年全国可疑医疗器械不良事件报告数量
二、医疗器械不良事件报告统计分析
(一)按报告来源统计分析
2013年医疗器械不良事件报★告中,使用单位上报175,317份,占报告总数的73.5%;生产企业上报7,274份,占报告总数的3.1%;经营企业上报█52,736份,占报告总数的22.1%;还有3,323份报告来自于个人,占报告总数的1.4%(图6)。
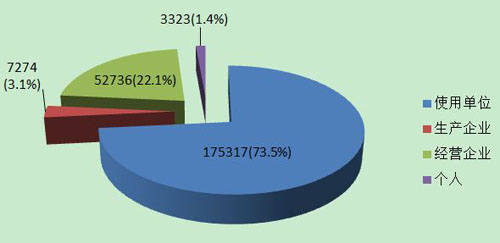
图6 2013年医疗器械不良事件报告来源
总体来看,来自于使用单位的报告较多,来自于生产企业的报告较少。相比2012年,生产企业的报告数绝对▼值及所占的百分比都有所上升,但仍与其第一责任人的地位不符。提示生产企业履行职责的自觉性≡还有待进一步提高。经营企业报告所占的百分比由2012年的21.58%上升至22.1%。
2013年,注册基层用户数量达到148,585,比2012年增加71.4%。但上报不良事件报告的单位所占比例与去年基本持平。在所有注册的基层用户中,仅有21.2%的用户提交过不良事件报告。其中,经营企业的上报比例最低,注册的61,498家用户中有9,576家提交了报告,仅占15.6%;生产企业注册的8,495家用户中有2,594家提交了报告,占30.5%;使用单位注册的78,592家用户中有19,335家提交了报告,占24.6%。尽管注册基层用户的数量大幅增加,但用户提交报告比例偏低,提示对基层用户的宣传培训、督促检查工作还需要进一步加强(图7)。
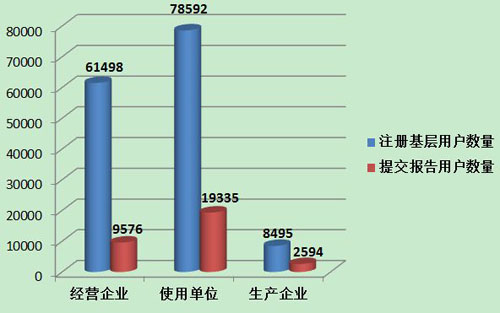
图7 2013年注册基层用户提交报告情况
(二)按事件伤害程度统计分析
2013年可疑医╳疗器械不良事件报告中,事件伤害为死亡的报告共75份,占总报告数的0.0003%;事件伤害为严重伤害的报告34,524份,占总报告数的14.5%;事件伤害为其他的报告共204,051份,占总报告数的85.5%(图8)。
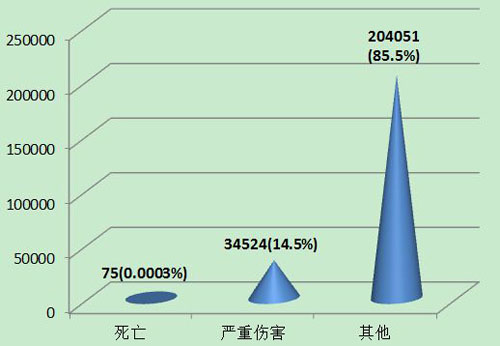
图8 2013年医疗器械不良事件报告事件伤害程度情况
2013年,严重伤害事件报告数量及所占比例均比2012年有所增加。总体来看,可疑医疗器械不良事件的报告数♀量延续了2009年以来的增长趋势,报告的质量及信息的可利用程●度等有了较大提升(图9)。
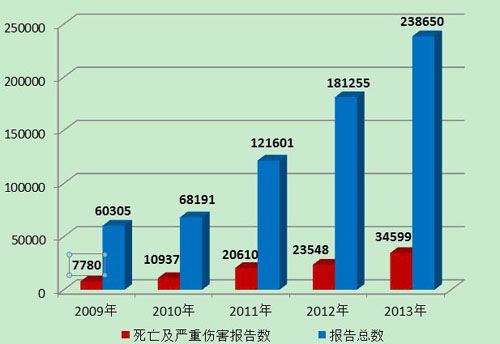
图9 2009-2013年全国报告数量与死亡及严重伤害报告数量比较
(三)按医疗器械管理类别统计分析
2013年医疗器械不良事件报告中,涉及Ⅲ类医疗器械的报告最多,共105,032份(其中死亡及严重伤害事件报告22,416份),占总报告数的44.0%;涉及Ⅱ类医疗器械的报告次之,共80,394份(其中死亡及严重伤害事件报告9,157份),占总报告数的33.7%;涉及Ⅰ类器械的■报告最少,共48,254份(其中死亡及严重伤害事件报告2,597份),占总报告数的20.2%;部分报告涉及的器∮械管理类别不详,共4,970份报告(其中死亡及严重伤害事件报告429份),占报告总数的2.1%。Ⅱ类、Ⅲ类医疗器械的报告是构成主体,与医疗器械风险程度高低相吻合(图10,图11)。
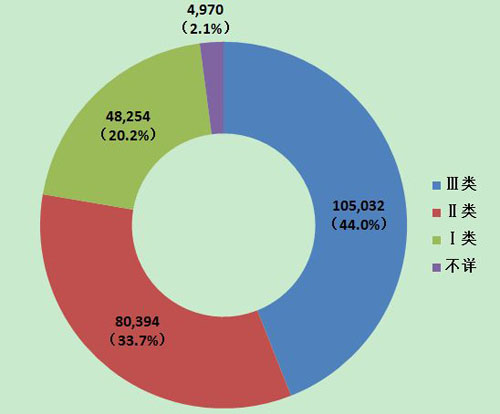
图10 2013年医疗器械不良事▂件报告涉及产品管理类别情况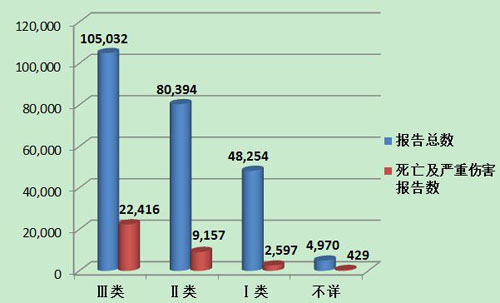
图11 2013年死亡及严重伤㊣害医疗器械不良事件报告涉及产品管理类别情况
(四)按医疗器械分类产品目录统计分析
按照现行的《医疗器械分类目录》,2013年的可疑医疗器械不良事件报告共涉及43类产品(除产品分类不详或未填写等其他外),涵盖了《医疗器械分类目录》中的所有医々疗器械类别。其中,报告数量位列前十位的产品类别依次为医←用高分子材料及制品,注射穿刺器械,医用卫生材料及敷料,植入材料和人工器官,物理治疗设备,医用光学器具、仪器及内窥镜设备,普通诊察器械,医用电子仪器设备,手术室、急救室、诊疗室设@ 备及器具和医用缝合╳材料及粘合剂。与2012年相比,报告数量位列前十位的产品类别完全相同,仅排名略有变化(表2)。
表2 2013年医疗器械不良事件报告涉及产品分类目录@情况
序号 | 分类 | 报告数 | 构成比(%) |
1 | 6866医用高分子】材料及制品 | 38413 | 16.1 |
2 | 6815注射穿刺器械 | 31589 | 13.2 |
3 | 6864医用卫生材料及敷料 | 30980 | 13.0 |
4 | 6846植入材料和人工器官 | 24912 | 10.4 |
5 | 6826物理治疗设备 | 24639 | 10.3 |
6 | 6822医用光学器具、仪器及内窥镜设备 | 13736 | 5.8 |
7 | 6820普通诊察器械 | 9695 | 4.1 |
8 | 6821医用电子仪器设备 | 7100 | 3.0 |
9 | 6854手术室、急救室、诊疗室设备及器具 | 6459 | 2.7 |
10 | 6865医用缝合材料及粘合剂 | 4830 | 2.0 |
(五)按可疑医疗器械不良事件报告数量排名前五位产品统计分析
2013年可疑医疗器械不良事件报告中,报↘告数量排名前五位的无源医疗器械分别为一次性使用输液器、宫内◣节育器╱、一次性使用无菌〇注射器、角膜接触镜和静脉留置针,占总报告数的34.0%,详见表3。报告数量排名前五位的有源医疗器械分别为病人监护仪、输液泵和注射泵、电子血压计、心电图机和呼吸机,占报告总数的4.3%,详见表4。
表3 报告数量排名前五位的无源医疗器械
序号 | 产品名称 | 报告数(n) | 占报告总数的百分比(%) | 严重伤害报告数 | 占本类产品报告数的百分比(%) |
1 | 一次性使用 输液器 | 28824 | 12.1 | 2148 | 7.5 |
2 | 宫内节育器 | 19822 | 8.3 | 9811 | 49.5 |
3 | 一次性使用无菌注射器 | 16517 | 6.9 | 823 | 5.0 |
4 | 角膜接触镜 | 8174 | 3.4 | 2201 | 26.9 |
5 | 静脉留置针 | 7857 | 3.3 | 1198 | 15.2 |
合计 | ?6?7 | 81194 | 34.0 | 16181 | - |
表4 报告数量排名前五位的有源医疗器械
序号 | 产品名称 | 报告数(n) | 占报告总数的百分比(%) | 严重伤害报告数 | 占本类产品报告数的百分比(%) |
|