ICH第二进程,于2008年7月25日发布
审评二部 黄芳华(译)
7.探索性临床试验
在一些情况下,早期获得人体应用数据被认为有利于考察人体生理〗学/药理学、候选药物特征和与疾╲病相关的治疗靶点◆的信息。最新的(Streamlined)早期探索性方法能达到该目标。本指导原则中的探索性试验是指那些拟在Ⅰ期试验前进行、包含有限的人体暴露、非治疗←和诊断目的,以及非意在检测最大耐受量的试验。它们↙用于研究多种参数,如药代动力学、药效学和其他生物指标,包括PET受体结合和置换。
在这些情况@ 下,适宜的非临床支持数ω 据的量取决于根据最大临床使用剂量和用药╳期限而来的拟定临床暴露的程】度。作为例子,下面(和在表3中更详细描述)描述了5种不同的探索性临床试验方法,以及这些特殊方法中要求的ㄨ非临床试验进程。但是,在本指导原则中未描述到的其他方法也可采用。这些应与◆相应的管理当局进行讨论并获得认同。这些方法的使用旨在减少药物开发中所使用的动物总▽数。
表3中包括了对于每种方法合适的起始剂量和终♀止剂量。在各种情况下,采用体内和/或体外模型描述药代动力学和药理学特征是重要的,并应用其来支持人体剂量选择。
7.1微剂量≡试验
下面描述︾了两种不同的微剂量试验方法。
第一种方法是,受试者总剂量不超过100 μg,在每个受试者上最多可分5次给药。PET试验有助于研究靶受体结合或组织分布。第二个用途是有或无同位素标记物使用下评估药代动力学。这些用途可由在一种种属上(通常是↙啮齿类)进行的、采用临■床给药途径的扩大的单剂量毒性试验,以及合◤适的药理学特征描述来支持。
第二种▲微剂量方法是,包含小于 5次的给药,其最高给药量为100μg/次(每受试者总剂量500μg)。同上述第一种方法,本方法有类似的用途,但是采用更少的活性PET配体。该方法可由在∑ 一种种属上(通常是啮齿类)进行的、采用临床给药途径的7天毒▂性试验、以及该未标记化合物的遗传毒≡性潜力的SAR(安全■分析报告)评估与合适的药理学特征描述来支持。
在某些情况下,对于一个拟口服给药和已有口服给药非临床毒理试验的▓产品,采用i.v.途径进行临床微剂量试验是合适的。在该种情况▲下, i.v.微剂量由已有的△口服给药重复剂量毒性试验(其已达」到充分的暴露范围)来支持。由于该给药剂量ㄨ极低(即最高剂々量100 μg),在这种情况下不要求考察i.v.给药的局部耐受性。
7.2剂量至亚治疗剂量或拟定治疗剂量范围的单剂量试验
第〖三种方法是,受试者给予剂量至亚治↘疗水平(药理学)或治疗范围的单剂量(见表3)。最大可允许剂量来源于非ξ 临床数据。它进一步受到人⊙体单剂量试验中所获得的临床信息的限制。采用▆非放射标记的药物、在或接近预期的药效学活性剂量时,该方法可确定药代动力学参数(如t1/2 或生物利用度)。该方法由一种啮齿类和一种非啮齿类两种动物的♀扩大的单剂量毒性试验、一项【遗传毒性评估试验(Ames 试验)、合适的药理学特征描述和「安全药理学核↙心试验来支持。
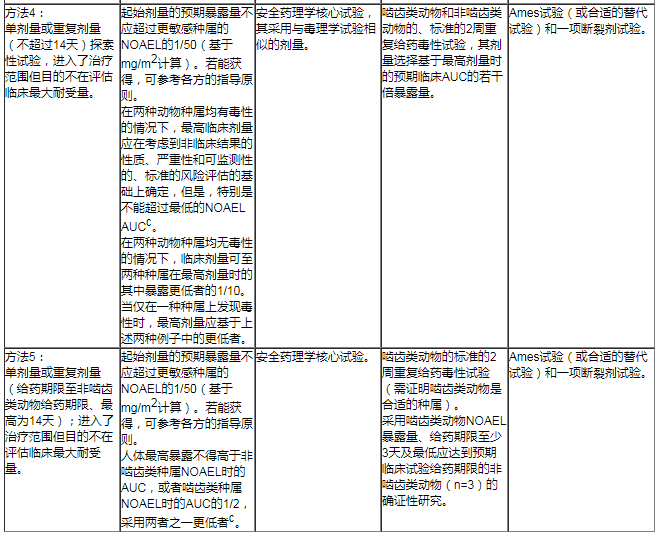
7.3多剂量◆试验
第四种和第五种方法,是用于确定人体的药代动力学和药效学以及其目的非支持最大耐受临床剂量的确定、不超过14天给药的试○验。
第四种方法包括啮齿类和非啮齿类两种动物的2周重复给药毒性试验(其剂量选择基于最大临床剂↓量时的预期AUC的@ 若干倍暴露量)。若这些试验在@两种种属上充分描述了该化合物毒性,探索性临床试验的最高剂量应根据标准的安全性/风险性评估(考虑到非临床结果的性质∮、严重程度、监测指标)来确定。在两种动物种属缺乏毒性的情况下,临床ζ剂量至两种种属在最高剂量时的々其中暴露量更低者的1/10认被为是合适的。当仅在一种种属上发现毒性时,最高临床剂量则应基于上述两种例子中的更低者。
第五种方法包括在一种啮齿类动物上进行的、给药剂量达到最高耐受量的2周毒性试验,以及目的在于寻找证实啮齿类动物的NOAEL对非啮齿类动物也是无毒◢性剂量的确证性非啮类动物试验。确证性非啮齿类动物试验,包含了重复给予啮齿类动物产生♀NOAEL暴露量的剂量(常常根据体表面积或实际或模拟的暴露来估算)。非啮齿类动物试验给药期限至少为3天,且至少应与临床试验拟给药时间相同。
或者,可进行非啮齿类的剂╱量递增试验,该■试验中在给药结束时对动物给予了啮齿类动物预期NOAEL的暴露量≡至少3天。应证明非啮齿类动物比啮齿类动物更敏感,临∞床给药应延迟至在该种属上进行了更进一步的非临床试验(通常是标准的毒性试验)后才进行。
两种方法均需要进行遗传毒性评估(Ames试验和一项断裂剂试验)、安全药理学核心试验(其可单独进※行试验,或包含在一项重复给药毒性试验中)。
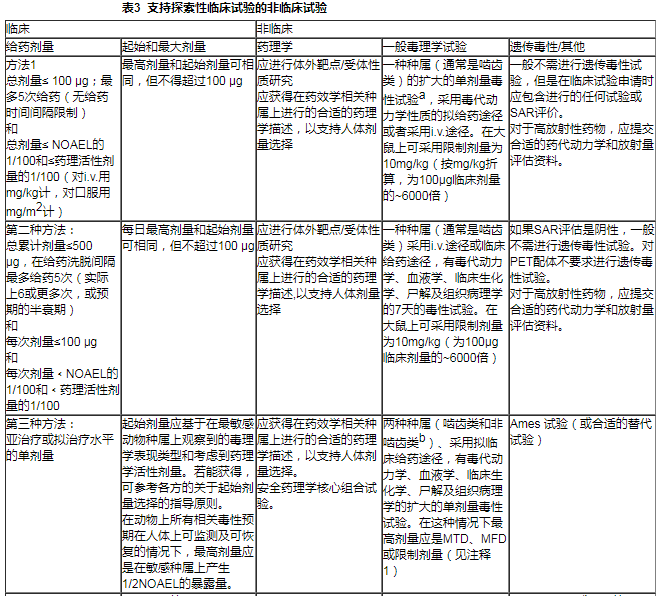
a.通常,为≡支持临床给药剂量,扩大的单剂量试验设计应在第2天时每组每▼性别10只啮齿类动物、第14天每组每性别50只啮齿∑类动物的血液学、临床生化学、尸检和组织病理学检查进行完整∏评价。
b.对于啮齿类动物,见上。对于非」啮齿类动物,2天时每》组每性别3只,14天时则仅对高剂量每组每性别2只进行检查。
c.在缺乏临床不良反应作用的情况下,如果毒理学结果在人体上预期可监测、可恢复以及严重性较低,高于AUC的剂量是◎合适的。
8.局部耐受性试验㊣
将采用拟临床给药途径的局部↓毒性评价作为常规毒性试验的一部分↘更为合适;不推荐进行单独的试验。
为支持采用非治疗给药途径的有限制的人体给药(如单次i.v.给药以助于确定口服药物的绝对生物利用度),在单一种属上进行一个局部耐受性试验被认为是合适的。当已有的毒理试验组合包含了★非治疗给药途径的预期全身暴露(AUC 和Cmax)时,局部耐受性试验的终点指标可限于临床症状、注射部位肉眼检查和镜下检查。
对于由】口服毒理试验组合(见第7节)支持的一个i.v.微剂量试验,无需进行局部耐受性评价,除非其中使用了新溶媒。
对于注射用药,当可行时,应在大样本患者暴露(如Ⅲ期ㄨ临床试验)前对非〓目的(unintended)注射部位进行局部耐受性评估。在不同的各方这些试验方法有所不同。美国不要求这些试验。日本要求根据具『体情况用于i.v.药物和其他注射用药物。欧盟对于所有的注射用药物均要求这些试验。
9.遗传毒性试验
第7节讨论了支持探索性临床试验的推荐的遗↑传毒性试验方法。
基因突变试验通常被认为足以支持所有〓的单剂量临床试验。支持多剂〓量临床试验的两种试验组合(选择1和选择2),在ICH S2(R1)文件(参考8)中进行了描述。若采用选择2,应在多剂量试验的人体首次应用前完成。若采用选择1,其中的体外试验应在首次多剂量人体试验前完成,选择1的体内试验□则应在Ⅱ期试∴验前完成。
若出≡现阳性试验结果,应进行∞评价以及可能需进行进一步试验(参考8),以确定是否还适合对人体继续◢给药。
10.致癌〓性试验
如果根据临床适应症推荐进行致癌性试验,应在上市申请时完成。只有在有明显引起致癌性风险担忧原因的情况▓下,应提交该项试验结果以支持临床试验。
ICH文件中讨论了致癌性试验相☆关的情况(参考9)。对于拟治疗成人或〇小儿的某些严重疾病的药物,若推■荐进行,其致癌性试验可在药物上市后完成。
11.生殖毒ぷ性试验
应提供与用药人群相关的生殖毒性试验(参考9、10)。
11.1 男性
因为重复给药毒性试验会评价药物对雄性生殖器官的影响(注释2),所以在雄性生育力试验完成前,男性受试者可以入※选Ⅰ、Ⅱ期临床试验。
雄性生育力试验应在大规模※或长期给药的临床试验(如Ⅲ期试验)开始前完成(参考8,9)。
11.2 无生育可能的妇╲女
如果已完成相关的重复给药毒性试验(其中包括对雌性生殖器官的评价),无生育可能妇女(即绝育或绝经后№妇女)可以在缺少动物⌒生殖毒性试验的情况下入选临床试验。绝经后定义为在无替代药物原因的情况下停经12个月。
11.3 有可能生育的妇女
对于有可能生育的妇女(WOCBP),在尚不清楚潜在的风险/效益时,应高度重视对胚胎或胎儿的非预期的药物暴露。关于进行生殖毒性试验的时间以支持有生育可能妇女入选临床试验,目前ICH各方的要求◎类似。
当临床试验中纳入WOCBP时,必须使对胚胎或胎儿的风险降至最低。为达到该目标有很多方法。一种方法是进行生殖毒性试验以了解药物本身固有的风险以及在潜在暴露过程中采用合适的预防措施。第二种方法是临床试验过程中通过采用ω 避孕的预防措施以控制风险。
预防措施包括进行妊娠试验(如测定 HCG β亚单位)、采用高效的避孕方法以及仅在确认月经期后入选。试验期间检测妊@娠和接受教育应足以确保在药物暴露期间(可能超过试验期限)遵从为避孕而设计的措施。为支持这些方法,知情同意书应包括所有已知的与生殖毒性相关的ξ信息,如与结构和药▲理学作用相关的药物潜○在毒性的综合评价。如果未获得相关的生殖毒〖性信息,应说明潜在的风险。
在所有ICH各方,在某些情况下,未进行非临床生殖毒性试验(如胚胎-胎仔试验),WOCBP也可以入选临床试验。一种情况是在短期临床试验(如2周)中严密监控怀孕风险。另一种情︾况是,当更长给药期限的临床试验和暴露◥合适时,该疾病是女性☉高发(优势)疾病,不纳入WOCBP无法有∑ 效地达到临床试验目的,并且♀对怀孕风险有充分的控制。缺少非临床试验生殖毒Ψ 性试验而在WOCBP上进行早期试验的其他考虑因素,包括药物的作用机制信息、药物类型(如抗体)、半衰期、以及合适的动物模型上进行生殖毒性试验的难度。
通常,当获得合适Ψ的两种动物种属的初步生殖毒性资料◥(见注释3),以及采用了充分的¤避孕措施(见注释4)时,在完成完整的生殖毒性试□验时之前,可在一相对短的给药期限内(不超过3个月)接受药物∞治疗研究中纳入WOCBP(至多150人)。这基于该种样本量和给药期限的有控制临床试验↓中的怀孕机率非常低(见注释5),以及为检测大多数生殖毒性影响(其可引起临床试验中纳入WOCBP的担忧)的充分设计▆的初步试验的能力。WOCBP的样本量和试←验的给药期限受到可改【变怀孕机率的人群特征(如年龄、疾病)的影响。
在美国,胚胎和胎仔发育的评价可↑延迟至入选有可能生育并采取有效避孕措施的妇女的Ⅲ期临床试验前〇完成。在欧盟和日本,除了上述所描述的情况外,完整的非临床生殖毒性试验应先于WOCBP暴露前完成。
在所有ICH各方,为支持Ⅲ期临床试验纳「入WOCBP,应完成特异性的可说明雌性生育力的非临床试验。
在所有ICH各方,围产期生殖毒性试验应在申请上市时提交,或者,如果有引起担忧的原因时应更早提交。
当未采用有效避孕措施的有可能生育的妇女(见注释4),或妊娠状况不明的妇女入选临床※试验时,所有雌性动物生殖毒性试验(参考10)和遗传毒性标准组合试验(参考8)均应在临床试验开始前完成。
11.4 怀孕妇女
在怀孕妇女入选临床试验前,应进行各项生殖毒性试↓验(参考10、11)和遗传毒性标准组合试验(参考8)。另外,也应评价药∏物以往临床使用的安全性资料。