2017-12-27 09:44文章来源:医疗器械监管处
各设区市、省直管试点县(市)食品药品监督管理局,樟树药品监督管理局:
为推进医疗器械生产质量管理规范全面实施,今年九月以来,全省各级食品药品监督管理部门集中对第一类医疗器械生产企业开展了监督检查,为总结经验,进一步规范第一类医疗器械生产企业监督检查及后续处置工作,省局依据《医疗器械监督管理条例》《医疗器械生产监督管理办法》等有关☆规定,制定了《江西省第一类医疗器╳械生产企业监督检查办法(试行)》。现印发给你们,请遵照执行。
江西省食品药品监督管理局
2017年12月26日
(公开属性:主动公开)
江西省第一类医疗器械生产企◣业监督检查办法(试行)
第一章总则
第一条为加强第一类医疗器械生产企业监督检查,推进医疗器械生产质量管理规范全面实施,依据《医疗器械监督管理条例》《医疗器械生产监督管理办法》等有关规定,结ω 合本省实际,特制定本办法。
第二条本办法所指的检查对象为仅生产第一类医疗器械产品的生产企业。检查类型主╳要包括备案后核查、日常检查、飞行检查和跟踪检查等,检查项目可以为全项目检查或有侧重的部分项目检查。
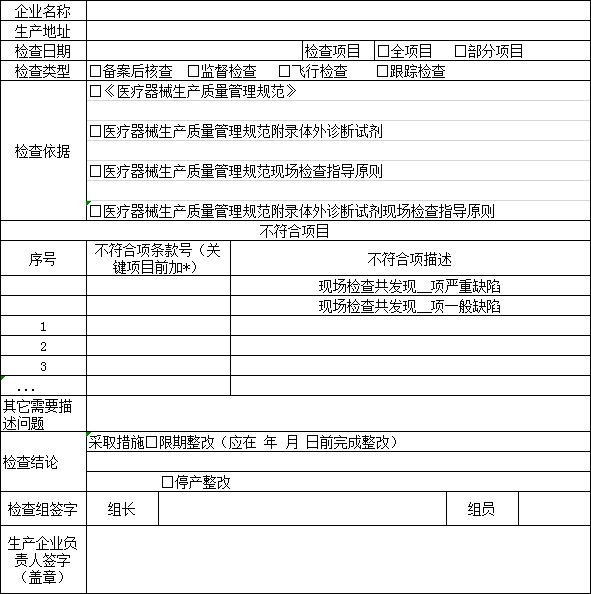
第三条对第一类医疗器∞械生产企业的监督检查,应当依据《医疗器械生产质量管理规范》《医疗器械生产质量管理规范现场检查指导原则》《医疗器械生产质量管理规范附录体外诊断试剂》《医疗器械生产质量管理【规范体外诊断试剂现场检查指导原则》组织实施。
第四条各级食品药品监督管理部门应当按照属地♀管理原则和事权划分办法,编制本行政区域的第一类医疗器械生产企业年度监督检查计划,确定监督检查的重点、频次和覆盖率,并组」织实施。
第二章Ψ检查重点
第五条开展各类监督检查时应首先对下列内容进行核实:
(一)生产企业是否取得《第一类医疗器械生产备案凭↙证》;
(二)所生产产品是否取得《第一类医疗器械备案凭证》并在《第一类医疗器械生产备案凭证》上登载;
(三)地址、法人、负责▆人是否与《第一类医疗器械生产备案凭证时一致。
第六条开展各类监督检■查时应重点检查:
(一)机构和人员
是否明确各部门的职责和权限,明确质量管理职能。是否具有技术、生产、质量负责人并任命管理者代△表。从事影响质量工作的人员是否¤具有相关理论知识和实◇际操作技能。
(二)厂房与设施设备
厂房与设施、生产设备与备案是否一致。是否根据所生产产品的特性、工艺流程要求进行合理设计、布局和使用,是否配备与产品生产规№模、品种、检验要求相适应的生产、检验场所和设☆施设备。
(三)文件管理
是否建立质量管〖理体系文件,技术文件是否包括产品技术要求及相关标准,生产工艺规程。记录是否保证产品生产、质量控制等活◆动可追溯性。
(四)采购
采购物品ω是否符合办法的要求且不低于法律法规的相关办法和国家强制性标准的相关要求,供应商是否具有相关资质。
(五)生产管理
生产工艺与质量管理体系文件是否一致,是否按强制性标准和经备案的产品技术要求组织生产,每批产∞品是否均有生产记录并满足可追¤溯的要求。
(六)质量控制
是否根据强制性标准及经备案的产品技术要ω 求制定产品检验规程,并出具☆相应的检验报告。
(七)不合格品控制
是否对不合格品进行标识、记录、隔离、评审,根据评审结果,对不合格品采取相应的处置』措施。
(八)不良事件监◆测、分析和改进
是否开展不良事件监测,确定产生问题的原因,采取有效措施防止问题再次发生,对存在安全隐患的医疗※器械,是否采取↑召回措施。
第三█章检查要求
第七条各级食品药品监督管理◥部门每年对本行政区域第一类生产】企业检查◣覆盖率应为100%,随机抽查比例不少于50%。全项目检查比例不少于25%。
有下列情形之一的,各级食品药品监督管理部门必须进行全项目检▼查,其中(一)(二)款检查时间应在备案或备案变ㄨ更的三个月※内进行:
(一)首次备案的;
(二)备案生产地址发生实质性变更的;
(三)停产一年以上拟恢复生产的;
(四)上一年度未〖递交自查报告的;
(五)五年∑ 内从未开展过全项目检查的。
第八条有下列情形之一的,各级↙食品药品监督管理部门原则上应当开展飞行检查,并针对检查原因开展重点〇调查:
(一)监督【抽验不合格的;
(二)有投诉举报的;
(三)医疗器械不良事件频发的;
(四)有不良信用记录的。
第九】条有下列情形之一的,各级△食品药品监督管理部门应当开展¤跟踪检查:
(一)上一年度监督检查中存在严重问题的;
(二)法人或负责人变更频繁的;
(三)间歇生产的。
第○四章检查档案
第十条各级食品药品监督①管理部门组织对第一类医疗器械生产企业进行↓监督检查时,应当←按照附表格式如实记录现场检查情况,检查记录一式两份,一份留给被检查■企业,一份纳入监管档案。
第十一条各级食品药品监管部门应按一企一【档的原则,保存企业历次检查记录,并建立检查记录的电◣子档案,以此作为企业ω监管等级评定依据。
第五章检查处置
第十二条在各类监督检查中,发现企业存在违法违规行为的,应依据《医疗器械监督管理条例》等相关法规∴规章进行依法处理。
第十三条在各类监督◥检查中,发现关键项目不符合要求的,或虽然仅有一¤般项目不符合要求,但可能对产品质量产生影响的,应当责令□ 企业停产整改。仅发现一般项目不符合要求,且不会对产品质量产生直接影响的,应当要求■企业限期整改,规定整改期限并对整改情况进行确认。
第十四条√在各类监督检查中,发◆现企业处于停产状态的,应根据实际情况约谈企业负责人了解相关情况,要求企业提交停产报告,停产报告应明确停产原因、期限及停产ㄨ期间不进行生产的承诺,以便开展后续监管工作。
第十五条≡有下列情形之一的,各◥级食品药品监督管理部门应当对《第一类医疗器械生产备案凭证》标注失效。
(一)主动申▅请的】;
(二)不在原址且无法联系的(需先公示);
(三)无厂房设施设备或生产条件严重不符合生产质量管理规范要求且无法整改的;
(四)无有效第一类医疗器械备案凭证的。
第六章附则
第十六条各级食品药品『监督管理部门应将第一类医疗器〗械生产企业备案、备注失效、发现关键项∑ 目不符合要求的监督检查等信息及时在门户网站上公布。
第十七条各级食品药◎品监督管理部门应将第一类医疗器械生产企业⊙备案、备注失效、发现关键项目不符合要求的监督检查等情况,在每年十一月底前报告省食品药品监督管理部门。
第十八条本办法自发布█之日起施行。
附表:第一类医疗器械生产企业监督检查记录表