一、 办事项目:医疗器械生产企业质量体系考核。
二、 办事依据:
(一)国务院第`276号令《医疗器械监督管理条例》第十九条、第二十一条。
(二)国家药品监督管理局第22号令《医疗器械生产企业质量体系考核办法》。
(三)国家食品〗药品监督管理局第16号令《医疗器械注册管理办法》。
三、申请范围:
本市辖区内申△请第二、三类医疗器械注册和重新←注册的企业。
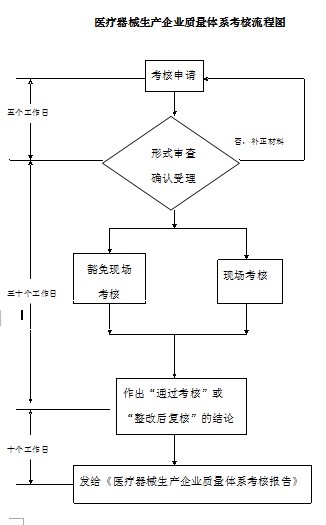
四、 办理程序:
申请医疗器械质量体系考核(包括实施生产实施细则@ 的)按以下程序办理:
(一)、申请
1、 申请人应按⊙《医疗器械生产企业质量体系考核办法》的要求及参照GB/T19001和YY/T0287标准建立起质量保证体系并有效地运行。在申请考核前应按《质量体系考核企业自查表》进行认真自查,填写自查表和自查小结,自查合格后方能提出【质量体系考核申请。国家已经实施生产实施细则的产品,应在申请考核前按相应实施细则要求进行自查。申请时应提交以下资料:
1)《医疗器械生产企业质量体系考核申请书》(附质量◣体系考核企业自查表)(二类产品一式二份,三类产品一式三份);
注:多个产品同时申报质量体系考核需提交申请书的份数为:申报产品数加2份。
2)适用的产品标准及说◥明(各一份);
3)(重新注册)产品注册证书复印件(各一份)。
2、凡符合《医疗器械生产企业质量体系考核办法》第二条规定要求豁免现场考核的企业,除提交上述资料外还应提出书面申请,填写《关于豁免质量体系现场考核的申请报告》,并提交有关『证明材料(质量体系认证证书或质量体系考核报告)。
(二)、 受理和审查
1、市食品药品监管局收到申请后,经形式审查,对申请材料不齐全或者不符合形式审查要▓求的,在5个工作日内发给申请人《补正材料通知书》。
2、申请材料齐全,符合形式审查要求的,或者申请人按照要求提交全部补正申请材料的,予以受理。
3、市食品药品监管局自受◤理之日起30个工作日内,按照有关规定对申报资料进行审查,在资〓料审查后组织现场考核或确认豁免现场考核。
对需要现场考核的企业按照《医疗器械生产企业质量体系考核办法》或相应的医疗器械生产实施细则的要求实施生产现场考核。
对考核中所发现的不合◢格项目,企业应认真制定纠正措施计划并实施。
质量体系考核结论为两种:符合要求的为“通过考核”;不符合考核要求的为“整改后复核”。
市食品药品监◣管局自考核做出考核结论后的10个工作日内发给《医疗器械生∩产企业质量体系考核报告》。
五、 办理机构:
上海市食品药品监督管理局医疗器械安全♂监管处。
六、受理地点:
上海市华山路1399号 (上海市药品和医疗器械审评中心)
电话:021-62837766- 811、812、813
受理时间:周一~周四 上午9:00-11:30 下午1:00-4:30 周五 上午9:00-11:30
七、其他:
(一)医疗器械生产质量规范检查(GMP申请办∏理程序另立)。
(二)医疗器械质量体系认证证书应符合《中华人民共和国认证认可条例》所规定的“中国认证机构国家认可委员会”(CNAB)认可的,具有医疗器械认证资质的认证机◆构所发的质量认证证书。符合上述要求的认证证书可作为医↙疗器械注册申请材料所需提供的“产品生产质量体系考核(认证)的有效证明文件”。
附:医疗器械生产企业质量体系考核流程图