浙江省食品药品监督管理局 www.zjfda.gov.cn 发布时间:2015-10-12 来源:医疗器械监管处
浙江省食品药品监≡督管理局关于印发《浙江省全面推进医疗〗器械生产质量管理规范实施工作方案》的通知
各市市场监督管理局(食品药品监督管理局):
为加强医疗器械生产监管,根据→国家食品药品监管总局《关于发№布医疗器械生产质量管理规范的公告》(2014年第64号)要求,结合我省实际,省⌒局制定了《浙江省卐全面推进医疗器械生产质量管理规范实施工作方案》,现印发给你们,请认真贯彻实施。
浙江省食品药品监督管理局
2015年9月25日
浙江省全面推进《医疗器械生产质量管理规范》实施工作方案
根据国家食品药品监管总局(以下简称“国家总局”)《关于发布医疗器械生产质量管理规范的公告》(2014年第64号)要求和省政府办↙公厅《关于“精准对接精准服务”支持医疗器械产业提升发展的若干意见》(浙政办发〔2014〕141号)精神,并结合我省实施《医疗器械生产质量管理规范》(2009年版)和医疗器械生产监管实际(详见附件1),为全面推进《医疗器械生产质量管理规范》实施,特制定以下工作方案。
一、指导思想按照国家总局、省政府医疗器械监管和产业发展工作的各项决策部署、医疗器械ξ监管法规规定和“四个最严”的要求,全面推进《医疗器械生产质量管理规范》的实施,加强▲医疗器械生产质量监管,切实保障人民群众用械安全有效。
二、工作目标分别自2016年1月1日起和2018年1月1日起,全省第三类医疗器械生产企业和全省所有医疗器械生产企业的医疗器械生产符合《医疗器械生产质量管理规范》(以下简称《规范》)要求。医疗器械生产◥企业建立完善的质量管理体系并有效运行,产品质量主体责任有效落实,医疗器械生产质量安全保障水平明显提高,医疗器械产业发展水平全面提升。
三、推进举措
(一)全力抓好第三类医疗器械生产企业《规范》的实施第三类医疗器械产品风险较高,2016年1月1日起要按照新版规范要求『组织生产,时间急,任务重。为此,省局将抽调专门力量在今年年底前按照《规范》及相关□附录要求,完成第三类□医疗器械生产企业《规范》执行情况的核查,监督企业按照《规范》要求建立健全质量管理体系并有效运行。
1、细化检查标准,开展针对性培训。省药品认证检查中心ㄨ(下称“认证中心”)按照《规范》及相关附录的▓要求,制定检查验收标准,细化检查条款内容,统一检∮查尺度,同时对现场检查人员、企业法定代表人和质量管理人员进行培训。
2、企业开展自查。第三类医疗器械生产企业按照《规范》及相关附录要求,对质量管理体系运行情况进行自◣查,并将自查结果形成自查报告№(见附件2)于今年年底前上报认证中心。已通过2009年版《规范》检查或IVD细则检查的137家企业也应于今年年底前将自查报告上报认证中心。认证中心将对上报自查报告企业的质量管理体系运行情↓况进行抽查。逾期未提交⌒质量管理运行情况自查报告的企业、逾期未提交质量管理运行情况自查报告的企业继续▲生产的,应按照《医疗器械监督管理条例》第六十八条的规定处罚。
3、组织现场检查。已取得《第三类医疗器械注≡册证》但未通过2009年版《规范》检查的35家企业,由认证中心按新版《规范》及附录要』求组织现场检查。如企业涉及《医疗器械生产许可证》延续、变更或申请第三类医疗器械注册∑ 核查的,可与新版《规范》检查一并进行。已取得《医疗器械生产企业许≡可证》但未取得《第三类医疗器械注册ζ证》的64家企业,如今年年底前已申请第三类医疗器械注册需要核查的,认证中心结合第三类医疗器械的注册质量管理▓体系核查一并安排检查。
4、抓好整改落实。自查或现场检查不符合《规范》要求★的企业应认真做好问题的■整改,并在今年年底前整改完毕。自2016年1月1日起,对不符合《规范》要求继续生产的企业,将按《医疗器械监督管理条例》第六十六条的规定进行处罚。因新修订的《医疗器械监督管理条例》实施了“先产品注册后生产许可”的制度,凡未取得《第三类医疗器械注册证》的第三类医疗器械生产企业应交回已核发的《医疗器械生产企业许可证》;凡未取得《第三类医疗器械注册证》的第二类医疗器械生产企业,由各市局缩减原核准的第三类医疗器械生产范围。
5、鼓励并购整合。为推进我省医疗器械产业转型升级、提升水平,鼓励和引♂导企业在《规范》实施∏中进行并购整合,做大做强做专企业。在符合医疗器械监管法规规定的前提下,省局将在产品注册和◥生产许可的制度衔接方面积极争取,予以支持。
(二)稳步推进第一二类医疗器械生产企业《规范》的实施对其余1100多家第一、二类医疗器械生产企业,各市局应参照第三类医疗器械生产企业实施《规范》的要求, 尽早▂摸底和筹划,并结合医疗器械生产监管和《医疗器械生产许可证》核发、延续、变更、注册核查、备案等↑工作,稳步推进,力求取得实效。对已取得第二类产品注册证但尚未通过2009年版《规范》检】查的企业,各地要排出任务单,列出进度表,充分了∩解并掌握企业实施规范的困难和差距,做好政∩策引导和督导服务。对2018年1月1日起不符合《规范》要求的医疗器械生产※企业,要依法查处直至吊销原生产企业许可证或生产备案表。
四、工作要求
(一)加强组织领导。医疗器械生产全面◥实施《规范》事关医疗器械№质量和安全,事关医疗器械产业健康发展,为加强工作▆的组织领导,省局成立《浙江省全面推进医疗器械生产质量管理规范实施工作领导小组》(见附件3),统筹工作的推进。各地应高度重视《规范》的实施,将辖区医疗器械生产企业实施《规范》工作作为医疗器械监管年度工作目标考核的重要内容,组织力量,采取措施,广泛宣传,积极引导和督促辖区企业尽◆早按新版《规范》要求完善硬件设施和质量管理体系并组织①生产。工作推进中,全省要树立“一盘棋”思想,服从工作的大局,听从省局的安排,并全力支持和配合检查员的调配,做好《规范》实施的现场检查。
(二)定ω 计划抓落实。各地要认真制定辖区《规范》实施工作计划, 明确任务和要求,严格把握《规范》的标准,同时,要将《规范》实∮施工作与生产许可、注册核查、日常检查等监管工作相结合。各地的工作计划于2015年10月31日前报省局医疗器械监管处。《规范》推进工作中,全省对实施《规范》的进度实行报告◎制度,各地每季度末※向省局报告工作进展情况,首次报告日期为今年年底。为推进《规范》的实施,各地对企业提出的问题要及时解答,对遇到的困难要积极指导◥并提供帮助。经过整改仍达不到《规范》要求或无能力达到《规范》要求的企业,各地要积极引导企业退、改、并、转。
(三)强化指导督查。为保证工作的顺▲利推进,省局⊙将加强《规范》实施工作的指导,及时解决各地推进过程中遇到的政策及技术上的困难和问题,对各地工作的进展情况进行检查和督查,并定期々进行通报。
附件:
1、全省医疗█器械生产企业实施2009年版《规范》和VID细则检查情况
2、浙江省医疗器械生产企业生产质量管理规范自查报告
3、浙江省全面推进医疗器械生产质量管理规范实施工作领导小组
附件1:
全省医疗器械生产企业实施2009年版《规范》和IVD细则检查情况
截止到2015年6月30日,全省共有《医疗器械生产许可证》生产企业875家,其中,第三类医疗器械生产企业236家,第二类医疗器械生产企业639家。第一类医疗器械备案♀(登记)企业466家。236家第三类医疗器械生产企业中,已通过旧版规范检查的企△业84家,通过体外诊Ψ断试剂(IVD)细则检↘查的企业53家,尚有99家≡企业未通过规范或ぷIVD细则检查(其中64家无有效或未取得第三类产品注册证),占比41%。639家第二类医疗器械生产企业中,已通过旧版规范检查的企业78家,通过IVD细则检查的企业20家,尚有541家企业未通过规范或IVD细则检查(其中155家无有效或未取得第二类产品注册证),占比84%。466家第一类医疗器械生产←企业均未通过规范检查。
附件2:
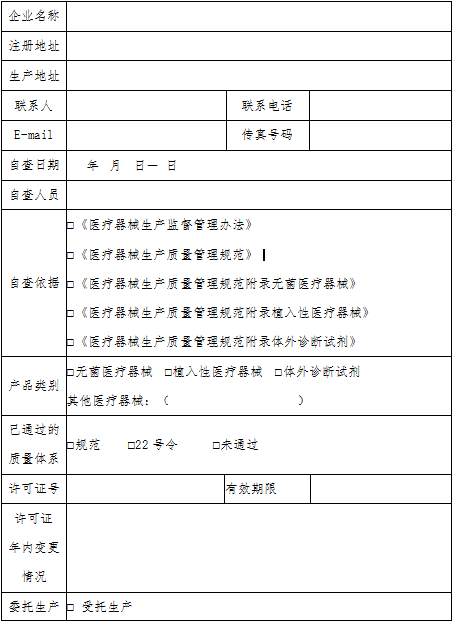
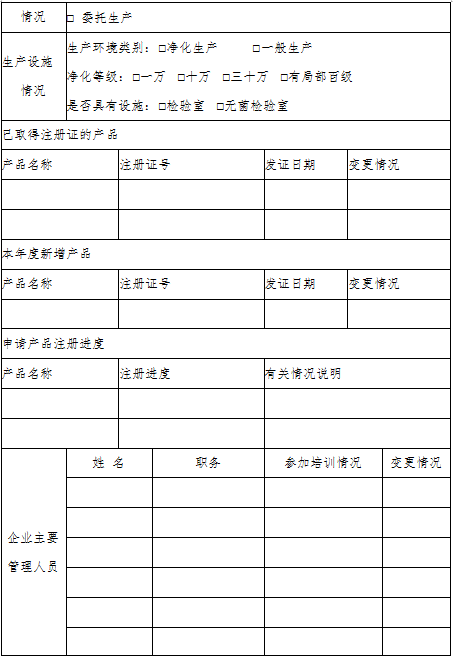
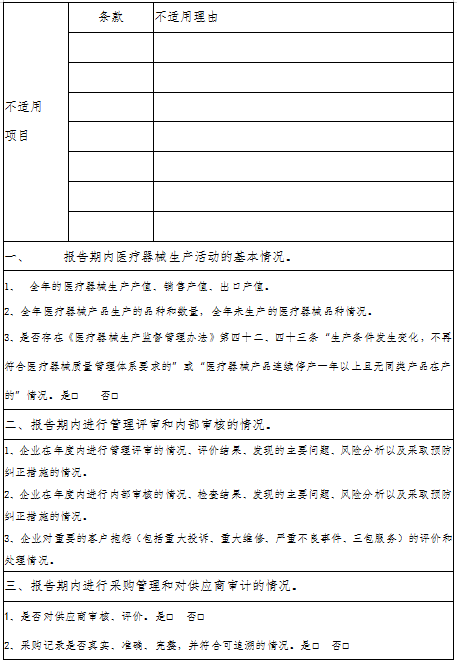
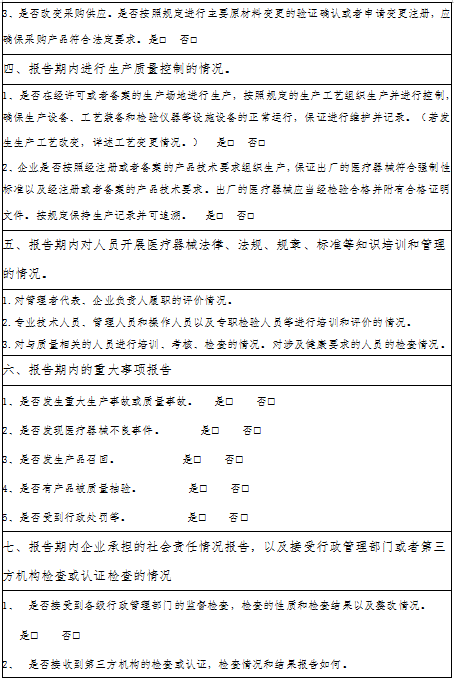
浙江省医疗器械生产企业生产质量管理规范自查报告

附件3:
浙江省全面推进医疗器械生产质量管理规范实施工作领导小组
组 长:苏志良总【工程师
副 组 长:省局医疗器械监管处董耿处长、省药品认证检查中心沈黎新主任
成 员:省局医疗器械监管处戴桂平副◢处长、各市局分管医疗器械监管的局领导领导小¤组下设办公室。
办公室主任:省局医疗器械监管处戴桂平副处长
办公⌒ 室成员:省局医疗器械监管处陈昱红、省药品认↓证检查中心王奇志、各市局医疗器械监管处处长
浙江省食品药品监督管理局办公室 2015年10月12日印发