2015-08-04 00:00 编辑:办公室
各设区市食品药品监督管理局,福州市、厦门市、平潭综合实验区市场监管局:
无菌和植入性医疗器械产品安全风险高。国家总局办公厅近日下发《关于开展无菌和植入性医疗器械监督检查工作的通知》(食药监办械〔2015〕95号),部署了无菌和植入性医疗器械监督检查工作,现就我省加强无菌和植入性医疗器械生产、经营、使用环节监督检查工作有关事项通知如下:
一、检查目标
通过对无菌和植入性医疗器械生产、经营、使用环节的监督检查,进一步提高生产经营企业和使用单位的质量管理水平,防范质量管理漏洞,保障生产、经营、使用环节的质量安全。
二、检查对象
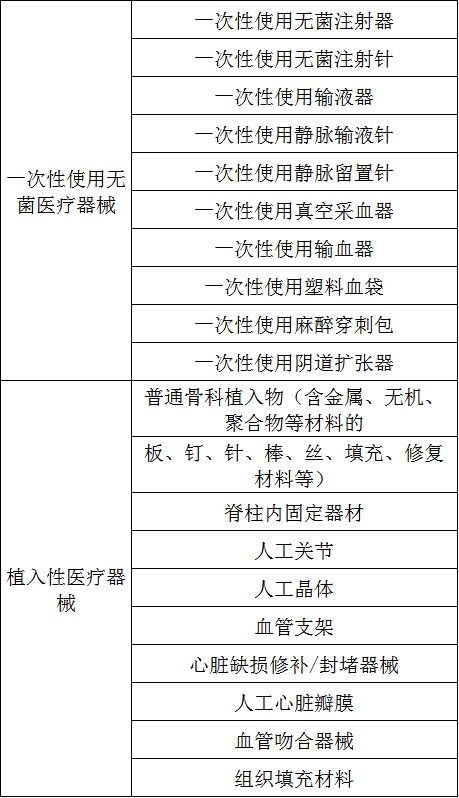
生产环节:全省生产19类(种)一次性使用无菌和植入性医疗器械(见附件1)的生产企业。
经营和使用环节:部分无菌和植入性医疗器械经营企业和使用单位。
三、检查重点内容
生产环节:(1)采购过程是否符合要求。重点检查企业采购物料是否符合法律、法规和国家强制性标准的要求,是否对采购物料进行检验或验证并保存相关记录。特别针对一次性使用输液器、一次性使用输血器等产品,重点检查采购记录、验收记录、财务票据等,检查企业是否存在擅自降低购进原材料标准的问题,必要时检查可延伸至相关供应商。(2)洁净室(区)的控制是否符合要求。(3)灭菌过程控制是否符合要求。尤其是产品的无菌性能和环氧乙烷残留量∮是否符合标准要求,是否有相应的检验或验证记录。(4)生产过程是否符合要求。重点检查一次性使用输液器、一次性使用输血器等产品,通过检查领料单、生产记录等,检查企业是否存在擅自添加增白剂或使用不符合相关标准原材〓料(如在生产过程中使用含有增白剂的原材料)的行为。(5)产品可追溯性是否符合要求。(6)出厂检验是否符合要求。是否按照经注册核准的产品标准(或技术要求)对产品进行出厂检验。
经营环节:(1)购销渠道是否合法;(2)进货查验记录和销售记录中的记录事项是否真实完整;(3)运输、储存条件是否符合标签和说明书的标示要求;(4)是否具有与所经营产品相适应的技术培训和售后服务能力。
使用环节:(1)产品购进渠道是否合法;(2)是否使用无产品注册证书、无合格证明、过期、失效或者淘汰的医疗器械;(3)植入性医疗器械的使用是否建立并保存可追溯的使用记录;(4)购进、验收记录是否齐全。
四、工作要求
(一)切实完成工作任务。生产环节检查。由省局组织对在《19类(种)一次性使用无菌和植入性医疗器械生产企业重点监督检查品种目录》(见附件1)内的生产企业,按照《医疗器械经营质量管理规范》标准进行1次全项目检查;同时,在11月底前由设区市食品药品监管部门按照规定的重点检查内容,至少组织1次重点检查,但本年度各设区市食品药品监管部门组织的重点检查次数应不少于3次。
经营和使用环节检查。由设区市食品药品监管部门根据《全省无菌和植入性医▓疗器械经营企业、使用单位监督检查任务∑安排表》(见附件2)确定辖区内检查对象,并根据《医疗器械经营质量管理规范》,按照经营、使用环节的检查重点内容,对这些检查对象组织1次以上重点检查。
(二)严格执法。对检查中发现存在违法行为的,应依据《医疗器械监督管理条例》等相关规定进行处罚;发现存在违规问题的,须责令企业(单位)限期整,并督促整改到位。
(三)落实复查。对存在违法违规行为的企业(单位)要组织复查,复查家次不得少于监督检查企业(单位)数的20%。
五、信息收集和报送
请于2015年11月25日前分别将生产、经々营和使用环节监督检查总结报告的电子版和纸质版报送省局。总结报告应包括对本辖区内无菌和植入性医疗器械生产、经营和使用环节检查情况(统计汇总表见附件3、4)、检查发现的主要问题、相关意见和建议等☉。
附件:1.19类(种)一次性使用无菌和植入性医疗器械生产企业重点监督检查品种目录
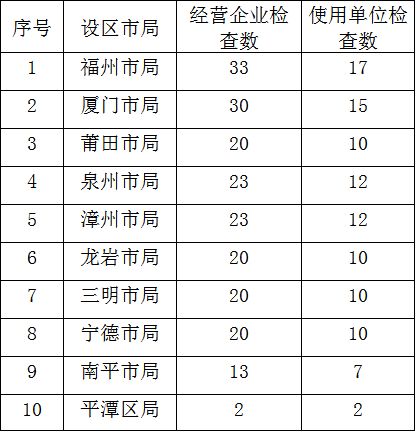
2.全省无菌和植入性医疗器械经营企业、使用单位监督检查任务安排表
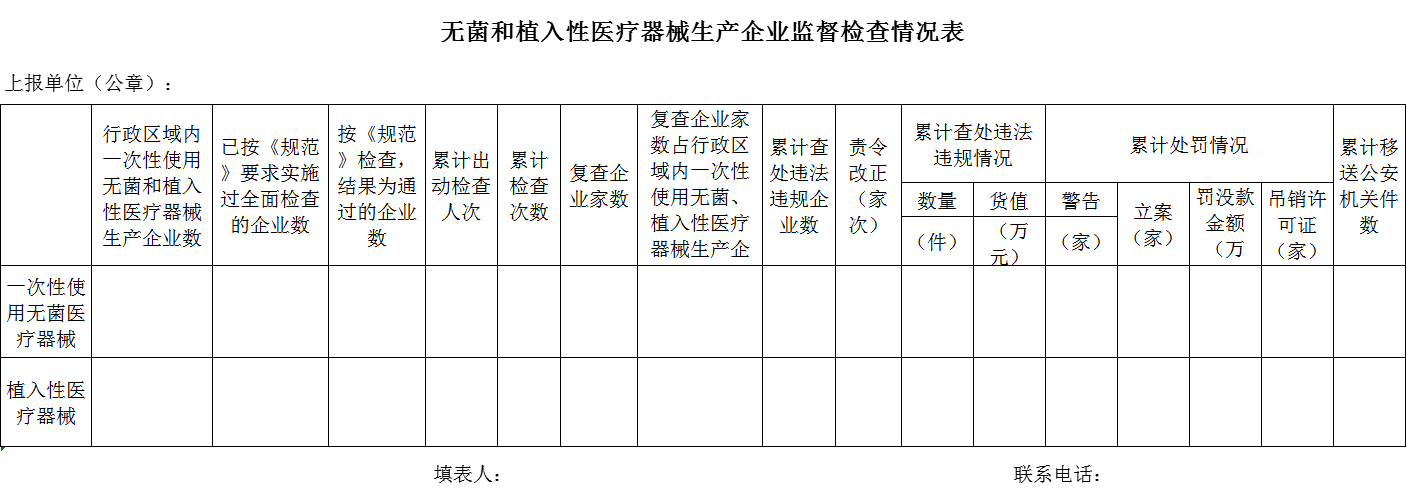
3.无菌和植入性医疗器械生产企业监督检查情况表
4.无菌和植入性医疗器械经营使用单位监督检查情况统计表
福建省食品药品监督管理局
2015年7月日
(公开属性:主动公开)
附件1
19种无菌和植入性医疗器械生产企业重点监督检查品种目录
附件2
全省无菌和植入性医疗器械经营企业、使用单位检查任务安排表
附件3
附件4
