一、注册基本条件:
1. 有拟注册的产品样品;
2. 已有拟注册产︻品适用的标准;
3. 已取得医疗器械生产企业许可证及法人单位营业执照;
二、首次注册程序: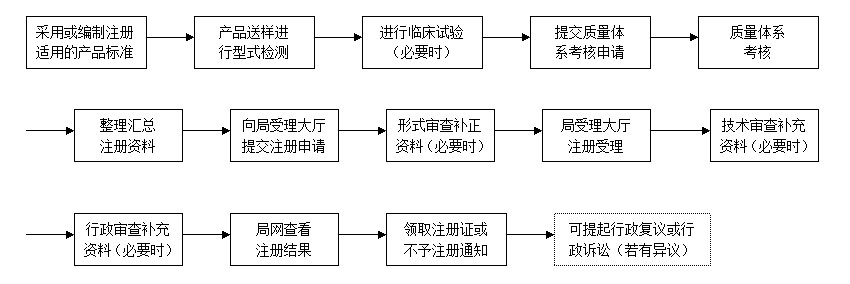
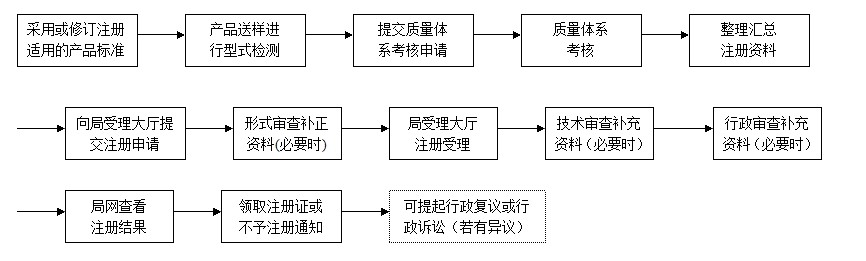
重新注册(产品无变化)程序:
三、注册审查时限:
出具受理通知】书后60个工作日内做出是否给予注册的决定(技●术审查时如通知申请单位补充材料,所需时间不包括在实质审查时限内,补充资料时间不超过60个工作日,超过时限且未书面陈述♂正当理由的,将终止审查。终ξ止审查后6个月内※不得再次申请。)
重新注册(原注册单元有产品实质性改变时),应按要求补充变化部分安全、有效性评价资料。
局受理大厅】:鼓楼街5号华▓阳大厦1 楼大厅;技术审查:省药品认证中◥心医疗器械审评部;行政审查:鼓楼街5号华阳大厦医疗器械处