bTMB往期临床研究々回顾
背景■知识介绍
TMB(Tumor Mutation Burden,肿瘤【突变负荷),也称为ML(Mutation Load),一般是指肿瘤基因组中平均1Mb范围内所包含的体细胞蛋白编码区点突变、插入缺失等基因变异数量,不同公司计算方法存在差异。
基于肿瘤组织样本计算的TMB为肿瘤TMB(tTMB);基于血』液样本计算的TMB为血液TMB(bTMB)。
TMB是用来研究免疫治疗疗效的一个生物标志物( Biomarker),于2018年10月被写入非小细胞肺癌2019.V1版NCCN指南中。
利用组织全外显子组测序( WES )和大Panel(一般是300个基因以上∑ )及循环肿瘤︻DNA( ctDNA )计算TMB的原理并无差异,差别是探○针覆盖区域的大小。
本期精彩看点
靶向PD-L1/PD-1通路的免疫检查点抑制剂已证实在多种实体瘤中具有生存期(OS)获益,如随机分配的III期OAK试验显示,atezolizumab治疗列队中的mOS为13.8个月,而多西紫杉≡醇治疗列队中□的mOS为9.6个月 [HR:0.73(95%CI:0.62-0.87); P=0.0003]。相比PD-L1阴性患者而言,PD-L1表达阳性的肿瘤患者有更大的临床获益,但单独的PD-L1表达并不能完全解释■用免疫抑制剂药物治疗的患者的OS获益。也就是说,PD-L1表达正迅〗速成为部分实体瘤一线治疗中首个可检测的生物标志物。这可能①使得用于随后的分子测试(如EGFR和ALK突变和TMB)的组织样本的可用性受到限制,如高达30%的NSCLC(非小细胞肺癌)患者在诊断时没有足够的组织用于标准生物标志物的检□ 测。因此,迫切需要开发非侵入性的诊断方法,帮助鉴定更多可能受益于抗PD-1/PD-L1治疗的患者。
既往研究≡表明,通过全外显子组测序(WES)测量的TMB值与多种检查点抑制剂的临床获益相关。部分♀研究也已经证明,与WES相比,有针对▲性的NGS Panel(一般在300基因以上)可准确测量tTMB(肿瘤TMB)。在目前阶▆段,与组织活检相比,通过简单抽血来分析肿瘤基因●组的能力具有明显的优势:
(1)血液是诊断同时期的可现成提供的材料来源;
(2)与单点▲的组织活检相比,血液检测可能不太容易受到潜在的取样偏差的影响,有助于减少肿瘤组织带来的异质性。
因此,对基于血液DNA检测的研究迅速增加,多种技术可以可靠地检测cfDNA中的突变,这些技术包括等位基因特异性PCR、ddPCR(液滴▂式数字PCR)和NGS。事实上,据不完全统计,FDA已经批准了5款基于NGS技术的肿瘤基因检测试剂盒(其中有2款是大Panel产品),CFDA也已经批准了5款基于NGS技术的肿瘤基因检测试剂盒。对于预测性生物标志物的检测,一些研究也表明NGS是一◥种有效的方法。科研工作者已经提出基于血液的TMB计算(bTMB)——使用cfDNA测量TMB用于预测性生物标志物的研究。
POPLAR(NCT01903993)和OAK(NCT02008227)研究【1】
最先报告bTMB测定法的开发、测试和验证的数据是々对POPLAR(NCT01903993)和OAK(NCT02008227)临床数据的分析展示。POPLAR研究评估了晚期或转移性NSCLC患者二线/三线atezolizumab治疗与标准治疗(多西紫杉醇)的情况,研究患者未经PD-L1状态分层 [ITT(意向治疗人群)人群N=287]。 OAK试验是一项随机III期研究,比较了atezolizumab与多西紫杉醇在转ξ 移性NSCLC中的关系,主要分析人群包括850名未经PD-L1状态分层的患者。这两项研究的■主要研究终点是OS,次要研究∮终点是PFS。在这两项研究中,与多西紫杉醇↑相比,atezolizumab均改善了OS,这使得FDA批准在铂类化疗期间或之后有疾病进展的晚⊙期NSCLC患者中使用atezolizumab(也称为Tecentriq; Genentech)。
OAK BEP(生物标志物可评估人群)(N=642)包括59名患有EGFR突变或ALK重排的◆患者和583名没有已知突变的患者。POPLAR BEP(N=211)包括15名患有EGFR突变或ALK重排的患者和196名没有已知突变的患者。基于POPLAR的数据,研究〗者确定了一系列与有临床意义结果相关∮的bTMB cut-off值,并在OAK研究中得到证实(图1)。
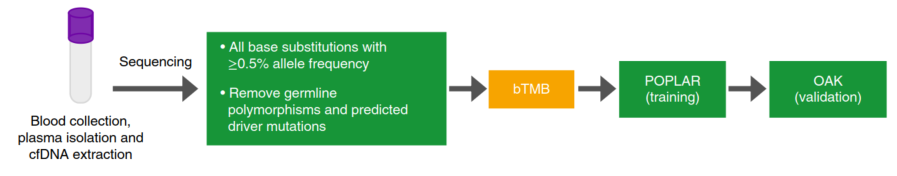
▲图1 bTMB测定研究示意图
(1)tTMB与bTMB的关系
POPLAR和OAK bTMB测定使用的是获FDA批准的靶向1.1Mb基因组编码序列区域的FoundationOne(F1)CDx NGS Panel。从患者的◥组织样本获得tTMB数据,从同一患者的血浆样本获得bTMB数据(N=259),观察到tTMB和bTMB值之间正相关(Spearman等级相关◢系数为0.64; 95%CI:0.56-0.71)(图2)。
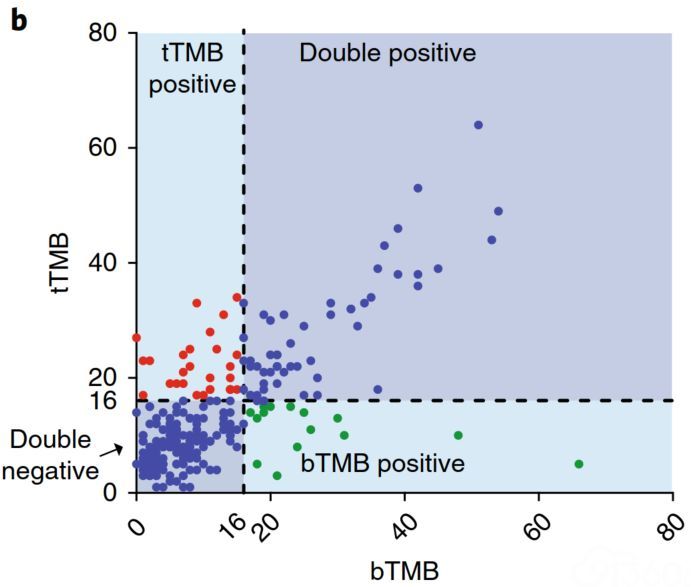
▲图2 来自POPLAR和OAK研究的同一患者中tTMB和bTMB一√致性比较(N=259)
有几个因素可能导致tTMB和bTMB之间缺乏更高的相关性:(1)计算算法存在◎差异,tTMB的╳算法纳入AF≥5%的SNVs(单核苷酸变异)和InDels(等位基因□的插入和缺失),而bTMB算法仅纳入AF≥0.5%的SNVs;(2)NSCLC存在肿瘤内异◢质性,单个活检样本的突变特征可能与转移性肿瘤释放到血液中的ctDNA突变特征显著不同;(3)样本特征可能存在差异∩,例如DNA来源、收集时间、样本类型、诊断阶段、肿瘤组织纯度、ctDNA的最大体细胞等位基因频率(MSAF)和cfDNA起始量的╱质量,这些与样本有关的因素均可能导致tTMB和bTMB之间的差异。
然而,研究者仅使用SNVs来比较tTMB和bTMB的相关性,发现这并没有带来相关性的改变(Spearman等级相关系数=0.65;95%CI:0.57~0.71),可能是因为计算tTMB时的InDels仅占该研究中体系突变的4%。
为了确定瘤内异质性是否可以解释血液和组织样★本之间TMB值的差异,研究者评估了血液和组织样本中存在的各种突变的情况(图3),发现:①对于血液和组织中TMB值较高(TMB>30个突变)的患者而言,三分之一的突变是血液样本所独有的,四分之一的突变是组织样本所独有的,剩下的部分突变在█2种样∑本中共存;②在组织中检测到>30个突变的↓患者,其bTMB和tTMB之间具有一系列的一致性∏;③22名患者中有7名在血液中检测到极少的突变,因此与组织的重叠很少;④68%的样本在组织和血液之▼间共享大多数TMB突变。
这些结果表明,组织和血液中不同突变的存在可能是导致tTMB和bTMB之间差异的很大一部分原≡因。同时研究者∑也评估了样本本身相关因素对tTMB和bTMB相关性的影响,发现在样』本身的相关因素中,影响tTMB和bTMB的相关性最重要因素是MSAF和样本采集间隔天数↘。
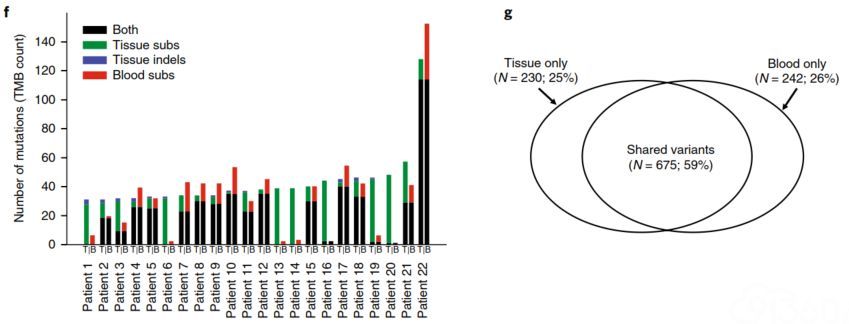
▲图3 左图:组织和血液样←本之间TMB值的比较;右图:突变维恩图△,重叠突变59%、仅组织突变25%、仅血⌒ 液突变26%
(2)bTMB的cut-off值的选择
研究者通过评估一系列预设的cut-off值(bTMB≥10~≥20)的PPA(阳性符合率╲)和NPA(阴性符合率)来选择测定性能最佳的cut-off值,结果发现不同cut-off值的PPA范围从85.7%(bTMB≥15)到100%(bTMB≥10);NPA范围从81.8%(bTMB≥19)到100%(bTMB≥10且≥16)。 结果表明,在bTMB≥10,≥16和≥20的三个cut-off值处测定性能最佳。 研究者选择这些bTMB cut-off值作为评估POPLAR研究结果№的基础。
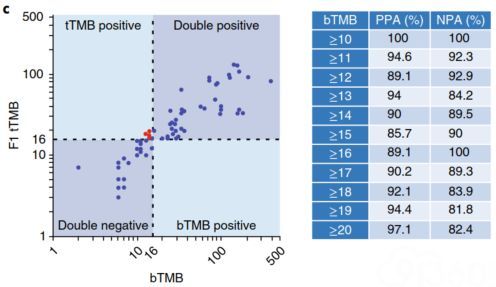
▲图4 左图:使用F1测定计算的▽TMB与来自ctDNA样品计◣算的bTMB的相关性比较(N=69细胞系);右图:预设的bTMB cut-off值的PPA和NPA
(3)POPLAR数据证明了bTMB cut-off值16作为临床结果的预测因子
为了评╳估临床疗效与bTMB评分之间的关系,研究者评估了POPLAR研究中287名意向治≡疗(ITT)患者的所↑有可用的基线血浆样本(N=273)。 由于血浆样本体积不够或MSAF较低,这273个样本中最终只有211个BEP样本达到了最小800×测序深度。结果发现(图5):与BEP人群相比,在 ITT人群中观察到PFS和OS的临床获益;在BEP中观察到bTMB≥10,≥16和≥20时,atezolizumab治疗列队的PFS和OS均得到改善♀; 在bTMB cut-off值≥16时,PFS HR=0.57(95%CI:0.33~0.99);atezolizumab列队和多西紫杉醇列队的mPFS分别为4.2个月和2.9个月、mOS分别为13.0个月和7.4个月。 bTMB≥16与治疗结果PFS之间的相互作◥用趋向显著,且在POPLAR研究的BEP中,bTMB≥16的患者占比为30%。因此在随后的验证研究OAK中选择≥16进行确证分析。
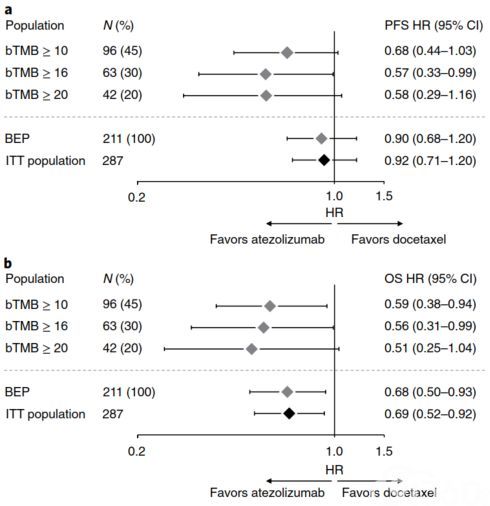
▲图5 POPLAR研究中PFS和OS的HR森林图
(4)OAK数据◥证实了bTMB是靶向PD-L1免疫疗法的潜在非侵入性生物标志物
在OAK研究中,主要分析ITT(N=850)和BEP(N=583),总体而言,BEP(PFS HR=0.87;OS HR=0.64)的临▂床结果优于ITT(PFS HR=0.95;OS HR=0.73)。在OAK 研究的BEP中bTMB≥16亚组的患者占比☆为27%。在bTMB≥16的患者中,比对多西紫杉醇治疗组,atezolizumab治疗组的PFS显著获益 [HR=0.65(95%CI:0.47~0.92); P = 0.013](图6)。在bTMB≥16的患者中,atezolizumab治疗组的mOS为13.5个月,而多西紫杉醇治疗组为6.8个月。
▲图6 OAK研究中PFS和OS的HR森林图
(5)bTMB与临床特征和免疫组化PD-L1表达的■关联
研究发现,在OAK 研究的BEP中,bTMB的阳性状态(≥16)与吸烟、基线时靶病灶最长径的总和(注:将用】于判断肿瘤缓解的一个指标)、转移灶数∮目和PD-L1表达有关。肺鳞癌↘和非肺鳞癌患者的平均bTMB值为11.22(95%CI:10.09~12.36)和12.4(95%CI:11~13.8)。
OAK研究表明,在ITT研究人群的PD-L1亚组中,与多∩西紫杉醇相比,atezolizumab显著改善OS;仅在表达高水平※的PD-L1 [TC3(≥50%的肿瘤细胞表达PD-L1)或IC3(≥10%肿瘤浸润性免疫细胞表达PD-L1)] 的亚组中观察到PFS显著获益。研究者㊣比较了bTMB和PD-L1 IHC之间的重叠情况来确》定在bTMB≥16的患者群体中观察到的临床获益是否可以通◥过PD-L1 TC3/IC3阳性群体来代表解释,发现bTMB和PD-L1 IHC亚组之间的重叠比例相似;bTMB独立于PD-L1高表达。
尽管在PD-L1高表达和bTMB之间未观察到显著相关性,但研△究者通过分析方法评估得到PD-L1与治疗相互作用HR为0.73(95%CI:0.46~1.13; P=0.160);bTMB与治疗相互作用HR为0.66(95%CI:0.45~0.97; P=0.035)。显著的与治疗相互作用表明,bTMB状态会♀影响PFS HR,同时控制PD-L1状态及其与治疗的相▃互作用。通过比较这两种生物标志物之间重叠和非重叠子◆集的PFS,发现bTMB≥16和PD-L1表达为TC3或IC3的患者似乎从atezolizumab治疗中获得最大临床获益。
总的来说,POPLAR和OAK研究是第一次证明TMB可以在血浆中准确和可重复地测量,并且bTMB与免疫检查点抑制剂治疗的⊙临床获益相关。在POPLAR样品中进行ξ分析然后在OAK样品中进行了确认,表明tTMB和bTMB呈正相关,且在NSCLC中bTMB≥16是具有临床︻意义的阈值,并★进一步表明bTMB与PD-L1高表达无关,并且可独立预测PFS的获益情况。当患者不适合活检或肿瘤@组织不可用时,使用血浆代替组织作为DNA来源检测TMB成为一种特别有吸引力的替代方案。POPLAR和OAK的∮研究结果也表明,多种生物标志物的组合可ξ能比任何单一ζ 生物标志物能更好地预测临床结果。
B-F1RST【2,3】
B-F1RST研究是一项单臂、1L NSCLC II期、前瞻性评估NGS Panel计算的bTMB作为atezolizumab单一疗法疗效预测标志物〓的研究。
(1)B-F1RST的初步研究结果【2】
B-F1RST初步研究的152位ITT患者中,119位BEP具有足够的ctDNA(MSAF≥1%);29 位ctDNA(MSAF<1%)不足 (非BEP)。预先指定 bTMB cut-off值为16(定义bTMB-H≥16,bTMB-L<16)用于评估ξ 临床疗效。主要终点是ORR和PFS。初步研究结果显示:最●低随访时间≥6个月,确诊的ITT ORR为14.5%(22/152); BEP中的ORR为10.1%(12/119),非BEP为34.5%(10/29);bTMB-H vs. bTMB-L的ORR为28.6%(8/28)vs. 4.4%(4/91),mPFS为4.6 vs. 3.7 mo; HR=0.66(90%CI,0.42-1.02; P=0.12)。不同bTMB值的mPFS列于表1中。 bTMB-H vs. bTMB-L的mOS是NE vs. 13.1 个月; HR=0.77(90%CI,0.41-1.43; P = 0.48)。13%的患者有治疗相关的严重AEs,20%患有治疗相关的Gr 3/4AEs。 15%的患者因AEs导致停药。总的来说,B-F1RST研究的初步分析是第一个完整的前瞻性◣数据集,评估bTMB作为接受atezolizumab单药治疗〓的1L患者的预测生物标志物的临床效用;bTMB-H(bTMB≥16)的患者其PFS、ORR和OS具有临床▲获益。
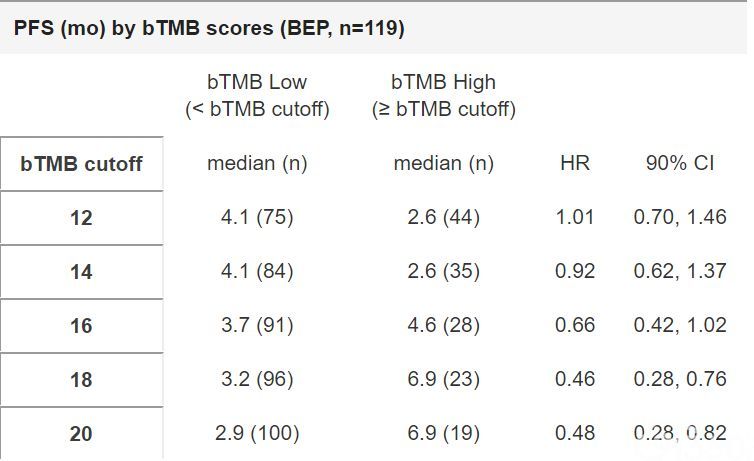
▲表1 不同bTMB值的mPFS(mo)(BEP,n=119)
(2)B-F1RST的中期↘研究结果【3】
B-F1RST研究的78例ξ中期分析群体(interim analysis population,IAP)中有58例BEP,BEP具有足够的血液样本使得具有足够的ctDNA(MSAF≥1%)用于检测。预先指定 bTMB cut-off值为16 [占比19%(11/58)]用于评估BEP的临床疗效,定义bTMB-H≥16,bTMB-L<16。中期B-F1RST研究结果表明:IAP和BEP的基线特征相似。最↘低随访时间为6个月,bTMB-H vs. bTMB-L 的mPFS为9.5 vs. 2.8 个月,HR为0.49(90%CI,0.23,1.04; P=0.11)。随着bTMB增加,PFS HR得到改善(表2)。在BEP中,ORR为12.1%(7/58),疾病控制「率为25.9%(15/58)。bTMB-H vs. bTMB-L其ORR为36.4%(4/11)vs. 6.4%(3/47);OR=8.38(90%CI,2.02,34.79; P=0.02)。治疗相关的严重AEs和治疗相关的3/4级AEs分别发生在14.1%和16.7%的患者中;15.4%经历过AEs的患者停药。B-F1RST的中期研究通过不同bTMB评分的PFS显示了bTMB作为PFS和ORR的预测生物标志物的初步效用,并且进一步支持了正〇在进行的1L BFAST研究(NCT03178552)中患者的bTMB选择。
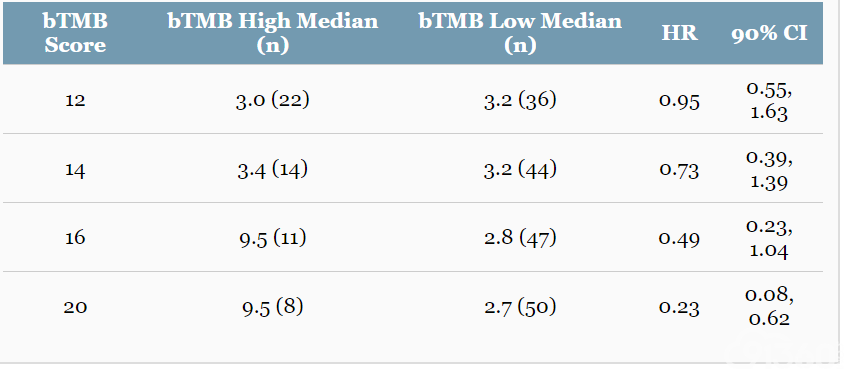
▲表2 不同bTMB值的mPFS(mo)(BEP,n=58)
尽管针对bTMB的临床研究▓结果需要进一步确认,但是这些研究提供了基于血浆的TMB检①测可以结合到常规临床护理中的应用前景。液体活检已经成为癌基因驱动的晚期实体瘤中基◥因组检测的可行策略,在患者的一线治疗之前和治疗中获得性耐药之后都具有明确的作用。基于NGS的基因检测有助于监测和确定这些机制。TMB的组织检测已经▃被纳入NSCLC指南,目前临床研究者正在开发基于血浆的NGS检测的评估→╲,未来可期。
参考文献
【1】Gandara DR, Paul SM, Kowanetz M, et al. Blood-based tumor mutational burden as a predictor of clinical bene?t in non-small-cell lung cancer patients treated with atezolizumab. Nat Med. 2018;24:1441-1448.【POPLAR&OAK】
【2】Kim ES VV, Mekhail T, Leal TA, et al. Primary ef?cacy results from B-F1RST, a prospective phase II trial evaluating blood-based tumour mutational burden(bTMB) as a predictive biomarker for atezolizumab (atezo) in 1L non-small cell lung cancer (NSCLC). Ann Oncol. 2018;29(suppl_8):mdy424.067.【B-F1RST初步研究结果】
【3】Velcheti V, Kim ES, Mekhail T, et al. Prospective clinical evaluation of blood-based tumor mutational burden (bTMB) as a predictive biomarker for atezolizumab(atezo) in 1L non-small cell lung cancer (NSCLC): interim B-F1RST results. J Clin Oncol. 2018;36(15_suppl):12001.【B-F1RST中期研究结果】