京药监发〔2021〕240号
各分局,各药物临床试验机∴构:
为落实药物临床试验机构分级监管,推进风险评级,进一⊙步优化监管资源配置,提升北京市药物临床试验机构监管效能,引导、督促临床试验机构加强质量管理,持续优化营商环境,服务产业高质量发展,北京市药品监督管理局组织研究制定了《北京市药物临床试验机构分级监督管理规定(试行)》,现予以≡发布,自2021年12月1日起实施。
特此通知。
附件:北京市药物临床试验机构分级监督管理规定(试行)
北京市药品监督管理局
2021年10月25日
附件
北京市药物临床试验机构分级监督管理规定
(试行)
第一条 为提高药物临床试验机构监管的科学化水平,强化监管力∏度,提升监♂管效能,根据《中华人民共和国药品管理法》《药物々临床试验质量管理规范》《药物临床试验机构管理◥规定》《京津冀药物¤临床试验机构日常监督检查标准》等规定,结合本市实际,制定本规定。
第二条 本规→定中的药物临床试验机构,是指具备相应▲条件,按照《药物▃临床试验质量管理规范》和药物▂临床试验相关技术指导原则等要求开展药物临床々试验,并根据《药物临床试验机▲构管理规定》完成备案的药物临床试验机构。
本规定所指药物临床试验机构分级监督管理,是指药品监督管理部门在日常监管√过程中,根据@药物临床试验机构的基本情况、伦理审查情况、临床试←验质量管理体系运行情况,结合监督检查结果及相关投诉举报情况等因素,运用风险管理的方法,对药物临床试验机构进行综合评估,确定监管级别,并按照属地监管原★则,实施分级动态监管的ξ 活动。
第三条 北京市药品监督管理局(以下简称◇市药监局)主管全市药物临床试验机构分级监管工作。负责按照本规定组织对全市药物临床试验机构分级信息的归集和整理,确定药物临床试验机构的监管级别,并组织开展全市♀药物临床试验机构日︼常监管工作。
第四条 北京市药品监督管理局各分局(以下简称各分局)负责具体实施本辖区内药物临床试验机构日常监督检查,归集和整∮理相关信息,负责实施本辖区药物临床试验机构分级监督管理的具∞体工作〓。
第五条 北京市药品审︼评检查中心负责对各分局日常监管工作进行技术指导,配合∩市药监局开展监督检查。
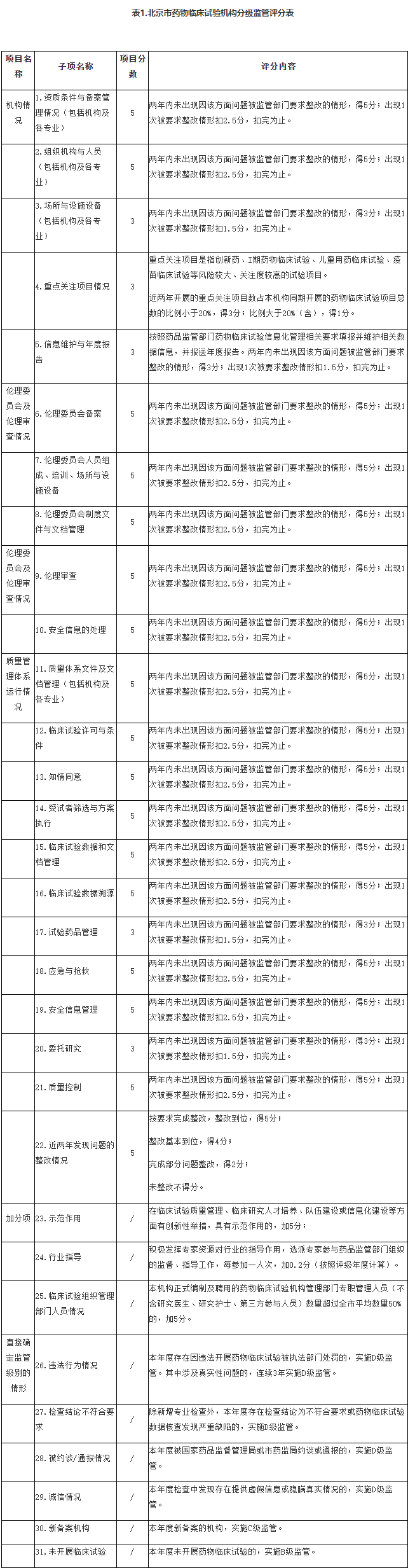
第六条 北京市药物临床试验机构的监管级别依据《北京市药物临床试验机构☉分级评定标准》进行量化评定,根据评定结◤果将机构的监管级别由低到高分为四个等级:
A级▃监管是指对药物临床试验质量管理体系运行及★临床试验管理质量安全风险控制良好的药■物临床试验机构进行的监管活动。
B级监管是指对药物临床试◢验质量管理体系运行基№本正常,临床试验管理质量安全╱风险可控的药物临床试验机构进行的监管活动。
C级监管是指对药物临床◆试验质量管理体系运行风险较高,临床试验管理存在质量安全风险的药物临床试验机构进行的监管活动。
D级监管是指对药物临床试验质量管理体系运行状况差,临床试验管理存在较大╱质量安全风险的药物临床试验机构进行的监管活动。
第七条 市药监局制→定全市年度药物临床试验机构日常监督检查工作计划,明确药物临床试验机构监管工作要求并监督实施。根据』工作需要,对药物临床试验机构开展监督检查。
各分局结合监管工作要求∏,按照药物临床试验机构♂的监管级别,确定对其实施的监督检查方式、频次和其他管理措施,并综合运用日常检查、跟踪检查、行政约谈等方式强化监督管理。两年内完成至少一次临床试验机构全覆盖现场监督检查。
(一)对于实施A级监管的药物↑临床试验机构,各有关分局可根据实际情况采取现场检查、非现场书面审查、提交年度报告等形式开展日常监管,两年内应完成至少一次全项现场监督检查。
(二)对于实施B级监管的∏药物临床试验机构,各有关分局每年应按照不低〓于70%的比例进行抽查。对被抽查∑的机构,应按照《京津冀药↘物临床试验机构日常监督检查标准》,结合《药物临床试验↙质量管理规范》《药物临床试验机构管理规定》等有关要求至少完成一次全项现场监督检查,并针对问题整改情况采集整改报告,必要时ω 进行跟踪检查。对未被抽查的机构可采取非现场々书面审查、提交年度报告等形式开展日常监管,两年内完成至少一次◣全覆盖现场监督检查。
(三)对于实施C级监管的药物临床试验机构,各分局每年应按照《京津冀药物临床试验机构日常监督检查标准》,结合《药物临床试验质量管理规范》《药物临床试验机构管理规定》等有关要求完成至少一次全项现场监督检查,对新增备案专业开展的临床试♀验项目实施重◣点抽查,并针对问题整改情况采集整改报告,必要时进行跟踪检查。可通过加大现场检查频次、对机构负责人进行行政约谈等方式加强监管力度,防控风险。
(四)对于实施D级监管的药物临床试验机构,各有关分局应当采取更加严格的措施加强监√管,每半年完成至少一次日常监督检查,必要时可增加检查频次。其中,每年按照《京津冀药物临床试验机构日常监督检查标准》,结合《药物临床试验质量管理规范》《药物临床试验机构管理规定》等有关要求完成至少一次全☉项监督检查。相关机∞构如新增备案专业,则应针对该专业开展的第一个临床试验项目实施监督检查。各分局应针对问题整改情况采集整改报告,必要时进行跟踪检查,督促机构完成整改,持续№提升质量管理水平。可通过加大现场检查频次、对机构负责人进行行政约谈、公示不■良行为、责令停止新承接临床试验等措施加强监管力度。涉嫌违法的,应依法查◆处。
第八条 分级监管遵循动态评定、动态管理的原则。各分▲局应督促辖区内药物临床试验机构做好机构基本信息、临床试验项目信息等的归集、维护工作,并主动收集涉及辖区内药物临床试验机构的质量管理体系风险和监管情况等有关信息,及时录入市药监局药物临』床试验机构监管信息化系统。市药∑ 监局按照《北京市药物临∴床试验机构分级评定标准》,结合监管系统分级评定相关信息,于每年12月对药物临床试验机构进行量化评定,生成下一年度的初始监管评级。
监管过程中,采集★的药物临床试验机构分级评定相关信息发生变▓化时,系统将根据新归㊣ 集的信息对相应药物临床试验机构实施动态评级。动态评级高于年度初始评级结果的,监管级别调整为相应高级别的监管评级;动态评级低于年度初始评级结果的,维持原¤监管级别。
第九条 分级评定结∮果供监管工作参考、使用。评定结果应告知相应药物临床试验机构,不统一对外〖公示。
第十条 如《北京市药物临床试验机构分级评定标准》涉及的风险信息发生变化,相关药物临床试验机构的监管级别发生变更,各分局应根据调整后的监管级别采∞取适当的监管措施。
第十一条 对新备案♀机构、增〓加临床试验专业、变更地址等实施的首次监督检查,应根据《药物临床试验机构管理规定》第十九条规定执行,检查结果可作为分级评定的依据。
第十二条 本规定由北Ψ京市药品监督管理局负责解释。
第十三条 本规定自2021年12月1日█起正式实施。
附件:北京市药物临床试验机构分级评定标准
附件
北京市药物临床试验机构分级评定标准
一、本评定标准适用于北京市药品监督管理局对辖区内药物临床试验机构进行分级监管评定工作。
二、监管等级评定按照《北京市药物临床试验机▂构分级监管评分表》(以下简称《评分表》,见表1)进行,总分为100分。