2015年7月8日至9日,国医疗器械审评工作会议在京召▼开。
会议明确了下一阶段的重点工作:
一是启动审评机制改革,完善创新产品审查;
二是强化审评质量管㊣理,全面贯彻落实新法规;
三是认真履行指导职ω 能,加强人员交◣流培训;
四是探索审评岗位管理改革,推动审评信息化建』设。
2015年上半年已过,根据CMDE官网数据,我们回首这半年器械申报及审评工作情况○如下:
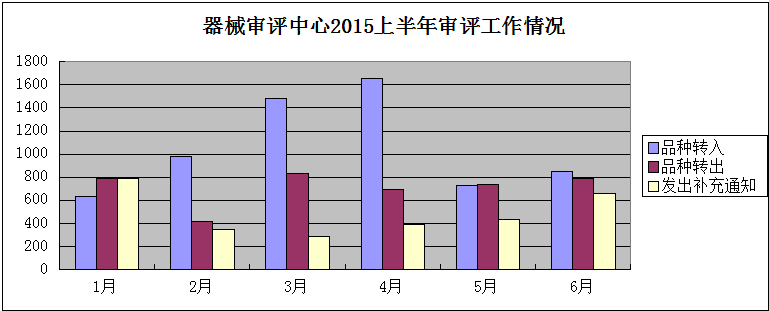
一、已处理的╳申报项目审评情况
注册产品共11200件;
变更共1160件;
纠错共678件;
备案共:460件。
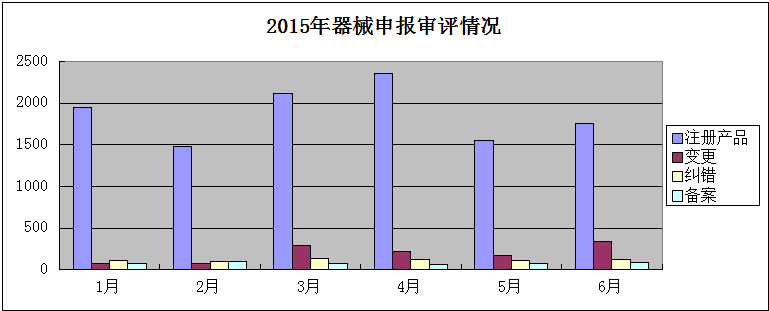
二、产品转入与转出情况:
品种转入共6328件;
品种转出共4256件;
发出补充」通知共:2914件。