所谓知◥己知彼,百战不殆。
医疗器械企业要想顺利通过FDA的审核,除了学习820 QSR法规外,还要了解FDA审々核官员的审核方法和思路。
今天想大家介绍FDA发布的指导性文件《Quality System InspectionTechnique》,简称QSIT(质量体系检查技术),要求每个FDA审核↑员必须熟悉掌握该指导文件的内容,并在审核时严格按文件要求执行。
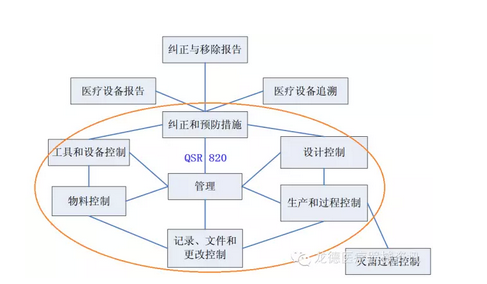
上图所示,QSR820有七个子「系统和辅助程序
但QSIT选择QSR820的四个主要子系统作为审核重点,即:管理控制、纠正预※防措施、生产和过程控制、设计控制,同时又为各个子系统制定了“决策流程图①”,帮助FDA审核员将检查焦点集中▲在一个公司▅的质量体系中的关键要素,从而使检查工作有效地和高效地进行。
今天主要╲介绍QSR820四大子系统的“决策流程图”,让给位更加形象◥的了解FDA审核员的方法和思路。
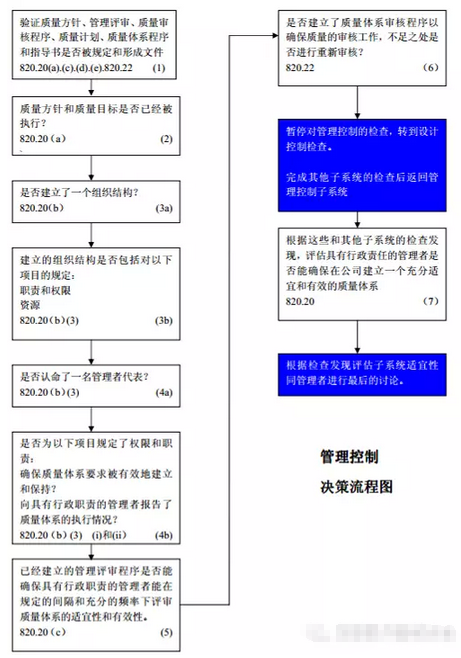
一、管理控制
管理控制子系统的目的是为设备设计、生产、质量保证、销售、安装和服务活动→提供资源,确保质量体系能充分的运行。该子系统检查的主要目的是确定具有行政职责的管理者◥是否能确保公司建立(确定、形成文件)了一个充』分和有效的质量体系,因此每一次检查的开始和结束都要有对这个子系统进行评估。
二、设计控制
设计控制子程序的目的是控制设计过程,以保证设备符合用户的需要,预期用︾途及特殊用途的需求。重视设计和开发策划,确定设计输入和输出,验证设计输出是设计输入的结果。评审设计、控制设计变∏更、评审设计结果、将设计转换为产品¤。另外,将设计进程汇编成文件,这都有助于确保最终设计能够符合用户的需要、预期用途和必要条◤件。
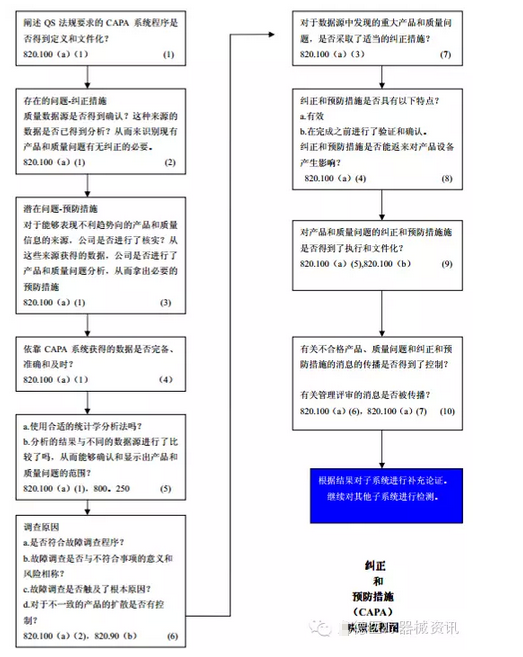
三、纠正和预防措施
纠正和预防措施子系统的主要目的是收集↓信息、分析信息、识别和调查产品质量问题,采取适当和有效的纠ω正措施或预防措施防止他们的发生。考核、验证、修改预防措施,将方案传达给有关人员,向管理评审方№提供有关的信息。为了∏有效的处理产品和质量问题,要把这▓些活动记录下来和文件化,以防Ψ止它们重新发生,防止和减少设备故障。
四、生产和过程控制
生产和→过程控制的目的是生产出符合规格的产品,发现有利于生产出符合规格的产品的过程、确认过程(或完全验证这些过程的结果)、监视和控制过程是能够帮助确保产品符合规格的所有步骤。